Quels aliments peuvent contribuer au maintien à domicile des personnes âgées ?
En France, les personnes âgées de plus de 75 ans représentent près d’une personne sur 10 selon les estimations réalisées par l’INSEE en 2019.1 Parmi elles, seules 10% fréquentent ou vivent dans un établissement d’hébergement pour personnes âgées.2 La majorité de cette tranche de la population reste donc à domicile avec une dépendance variable.

Avec l’âge, on observe des changements de mode de vie dus au déclin des capacités physiques et à l’évolution de l’état psychologique. Ceci peut ainsi se traduire par une diminution de l’activité physique accompagnée d’une réduction des apports alimentaires. La perte de poids peut alors être importante, ce qui n’est pas sans risque pour une personne âgée : des maladies comme la sarcopénie ou l’ostéoporose peuvent survenir.3 4
Il apparaît ainsi indispensable de pouvoir apporter des produits adaptés aux personnes âgées pour s’assurer que leurs apports alimentaires restent suffisants. En effet, ceux-ci peuvent s’avérer importants afin de maintenir des apports alimentaires adaptés et ainsi conserver un mode de vie sain.
Une étude statistique américaine de 2018 a notamment révélé qu’un mode de vie sain (bonnes habitudes alimentaires et apports adéquats, consommation modérée d’alcool, etc…) permettrait potentiellement d’augmenter la durée de vie de 12,2 ans pour les hommes et de 14 ans pour les femmes.5 A titre comparatif, la durée de vie moyenne aux Etats-Unis est de 78,5 ans (donnée de 2017).6

Pourquoi faut-il des produits « adaptés » aux personnes âgées ? Les produits courants ne suffisent-ils pas ?
Les produits alimentaires courants ne doivent évidemment pas être écartés. Mais de nombreuses études ont démontré que les apports alimentaires ont fortement tendance à diminuer avec l’âge.3 7 8 9 On estime qu’entre l’âge de 20 et 80 ans, les apports énergétiques baissent en moyenne de 600 et 1300kcal respectivement chez les femmes et les hommes.10 Ceci représente une diminution des apports énergétiques moyens pouvant aller jusqu’à 50%. Une telle diminution des apports n’est pas sans conséquence sur l’organisme : diminution des capacités cognitives et physiques, augmentation de la fatigue, affaiblissement du système immunitaire, etc… Une méta-analyse de 2018 a notamment démontré que la qualité de vie des personnes âgées était directement liée à leurs habitudes alimentaires. 11
Par conséquent, des suppléments alimentaires peuvent être nécessaires pour mieux couvrir les besoins énergétiques des personnes âgées. Trois types de produits existent alors :
- Les compléments alimentaires, qui peuvent s’avérer utiles pour apporter des vitamines, minéraux ou d’autres nutriments essentiels comme les omégas 3. L’inconvénient majeur de ceux-ci est qu’ils peuvent être difficiles à avaler pour certaines personnes âgées, notamment ceux souffrant de dysphagie (difficulté à avaler). De plus, ces produits peuvent être perçus par les personnes âgées comme des médicaments. Une certaine aversion peut donc parfois être observée.
- Les aliments fonctionnels, c’est-à-dire des aliments semblables en apparence à des aliments conventionnels, mais renfermant un ou plusieurs éléments bénéfiques pour la santé.12 Ceux-ci vont souvent contenir un concentré de nutriments essentiels. Ils peuvent par exemple être présentés sous la forme de boissons lactées, de crèmes dessert ou même de potage.
- Les produits « manger-main », qui sont des aliments classiques mais dont la forme et la consistance permettent d’être mangés avec les doigts. Ces aliments vont généralement être des concentrés d’énergie et de nutriments essentiels. L’avantage de ces produits est qu’ils sont simples à manger pour les personnes âgées ayant du mal à utiliser des couverts (comme les patients souffrant de la maladie de Parkinson). De plus, ils peuvent être facilement ajoutés dans un plat ou être consommés à tout moment de la journée sans forcément être à table.

Quels sont les nutriments que l’on doit retrouver en priorité dans ces produits adaptés aux personnes âgées ?
Nous avons vu précédemment que les apports énergétiques des personnes âgées étaient bien souvent insuffisants. Un produit destiné à ces populations pourrait donc être un condensé d’énergie et donc être plus riche en graisses. Les lipides sont en effet les nutriments les plus énergétiques : les glucides et protéines représentent approximativement 4kcal/g tandis que les lipides 9kcal/g. Concernant la qualité de ces graisses, l’idéal est de maximiser les omégas 3 puisqu’il s’agit d’acides gras essentiels trop peu présents dans l’alimentation courante. Différentes études épidémiologiques ont notamment démontré qu’une consommation accrue d’omégas 3 permettrait de limiter le risque d’accidents vasculaires ainsi que les déclins cognitifs.10 13 14
Les protéines sont également extrêmement importantes pour les personnes âgées puisqu’elles permettent de maintenir l’intégrité de leur masse musculaire et osseuse. Ceci permet ainsi à ces populations de mieux préserver leurs capacités physiques. Pour plus d’informations, nous avons abordé ce sujet dans plusieurs de nos articles de blog :
- « Quels sont les besoins protéiques des seniors et personnes âgées ?«
- « Quelles sont les protéines les plus adaptées pour répondre aux besoins des seniors ? »
- « En quoi les protéines sont-elles bénéfiques pour la santé osseuse ? »

Avec l’âge, une certaine résistance anabolique A peut survenir. En d’autres termes, une petite quantité de protéines peut ne plus suffire à stimuler la synthèse musculaire.15 Cependant, il reste possible de contrebalancer ce phénomène en apportant une quantité suffisante d’acides aminés essentiels B et notamment de Leucine, l’acide aminé le plus important pour stimuler l’anabolisme.16 17 Ainsi, une dose comprise entre 2 et 3g de Leucine représenterait la quantité minimale par prise alimentaire pour stimuler correctement l’anabolisme chez les personnes âgées.15 18 19
Par ailleurs, il est important de souligner que l’alimentation seule ne suffit pas : une activité physique (même simplement marcher) est indispensable afin de maintenir les muscles stimulés. Pour davantage de précisions, consultez notre article sur les besoins protéiques des seniors et personnes âgées.

L’ajout de micronutriments peut également être intéressant. D’après les recommandations issues de la review de 2016 Nutrition recommendations in elderly and aging. Medical Clinics of North America, les nutriments dont l’insuffisance est courante et représentant le plus de risque pour la santé sont la vitamine D et B12, ainsi que le Calcium. Il s’agit donc des trois micronutriments à inclure en priorité dans les produits destinées aux personnes âgées.19
Si les aliments sont plus énergétiques, les personnes âgées ne risquent-elles pas de manger moins pour compenser ?
Non, à condition que le volume du plat ne varie pas. Une étude menée en milieu hospitalier sur 36 patients âgés de 52 à 96 ans a en effet révélé que le volume de nourriture ingéré entre un plat ordinaire et un plat à la densité énergétique supérieure est négligeable. Ainsi, il est possible d’augmenter significativement les apports énergétiques en apportant des produits alimentaires à haute densité énergétique.20
Quels aliments doivent contenir ces produits adaptés aux personnes âgées ?
Tous les aliments ne peuvent pas convenir aux personnes âgées. Non pas pour des raisons de santé, mais simplement pour le côté hédonique du produit. Comme nous l’avons vu précédemment, on observe souvent un déclin de l’appétit avec l’âge. Le produit doit donc être le plus appétissant possible pour que la personne âgée ait envie de le consommer.8
Une étude de 2008 du Journal of Nutrition Health and Aging suggère que plus des aliments suscitent des émotions négatives (dégoût, indifférence, inquiétude, doute, frustration, déception, lassitude), plus le risque de sous-nutrition est important. Il semble ainsi primordial de sélectionner des aliments suscitant des émotions positives chez ces populations.21
Quels aliments peuvent susciter ces émotions positives chez les personnes âgées ?
Une étude de 2006 démontre que les plats préférés des personnes âgées semblent être ceux dont la préparation reste traditionnelle et dont les produits sont des aliments qui leur sont familiers. Il faut donc oublier les méthodes de préparation trop élaborées et les aliments sortant de l’ordinaire et rester dans ce que les personnes âgées connaissent.22
Ainsi, les aromatisations doivent toujours rester simples : vanille, chocolat, caramel, café… Par ailleurs, il n’est pas rare que les capacités sensorielles diminuent avec l’âge. Le goût et l’odorat pouvant faiblir, il apparaît nécessaire de relever davantage les saveurs des aliments et de proposer des arômes plus forts que ceux utilisés traditionnellement.
Ces aliments doivent-ils répondre à certaines exigences particulières ?
Outre les nutriments et l’aspect hédonique vus précédemment, les produits à destination des personnes âgées doivent avoir une forme et une texture adaptées pour répondre aux problématiques imposées par certaines maladies. La dysphagie et la xérostomie (sécheresse buccale) imposent notamment aux produits d’adopter une texture particulière.23
Il peut également être pertinent de présenter les produits sous forme de bouchées afin qu’ils puissent être consommer sans couverts. Dans cette mesure, les produits « manger-main » peuvent être tout particulièrement intéressants.

Pour conclure, pour être parfaitement adapté aux personnes âgées, un produit alimentaire doit :
- Être énergétique et source de nutriments indispensables, notamment des vitamines (D et B12), des minéraux (calcium) ainsi que des protéines. A noter que pour ces dernières, il est important de sélectionner une protéine riche en Leucine. De ce fait, les protéines laitières peuvent s’avérer très pertinentes, le whey contenant 11,7% de Leucine et les caséines micellaires 9,2%. *
- Être attractif, il doit susciter des émotions positives. Mais il ne doit pas pour autant être trop extravagant : les personnes âgées préfèrent généralement les produits qui leur sont familiers.
- Être facile à consommer, donc avoir une texture et une forme adaptée (pas trop dur, ni trop sec par exemple).
* les valeurs de Leucine données correspondent à celles mesurées dans les produits Prodiet® 80S pour le whey et Prodiet® Fluid pour les caséines micellaires. Ces produits sont développés par Ingredia.
* A [Acide aminé essentiel] : Acide aminé que l’organisme n’est pas capable de synthétiser et qu’il est indispensable d’apporter par l’alimentation
* B [Biodisponible] : relatif à l’absorption et l’utilisation d’un élément par l’organisme. Plus un nutriment est biodisponible, plus celui-ci est absorbé et utilisé par l’organisme.
Pour plus d’informations, n’hésitez pas à nous contacter.
Auteurs : Rémi Maleterre & Audrey Boulier.
________________________________________________________________________________________________
[1] “Population Par Âge − Tableaux de l’économie Française | Insee,” accessed April 9, 2020, https://www.insee.fr/fr/statistiques/3676587?sommaire=3696937.
[2] DREES, “728 000 Résidents En Établissements d’hébergement Pour Personnes Âgées En 2015,” Études & Résultats, 2015, https://drees.solidarites-sante.gouv.fr/IMG/pdf/er1015.pdf.
[3] Sonya Brownie, “Why Are Elderly Individuals at Risk of Nutritional Deficiency?,” International Journal of Nursing Practice 12, no. 2 (2006): 110–18, https://doi.org/10.1111/j.1440-172X.2006.00557.x.
[4] Alfonso J. Cruz-Jentoft et al., “Prevalence of and Interventions for Sarcopenia in Ageing Adults: A Systematic Review. Report of the International Sarcopenia Initiative (EWGSOP and IWGS),” Age and Ageing 43, no. 6 (November 1, 2014): 748–59, https://doi.org/10.1093/ageing/afu115.
[5] Yanping Li et al., “Impact of Healthy Lifestyle Factors on Life Expectancies in the US Population,” Circulation, July 2018, https://doi.org/10.1161/CIRCULATIONAHA.117.032047.
[6] “Indicateurs de Développement Dans Le Monde – Google Public Data Explorer,” accessed August 30, 2020, https://www.google.com/publicdata/explore?ds=d5bncppjof8f9_&met_y=sp_dyn_le00_in&idim=country:USA:GBR:CAN&hl=fr&dl=fr#!ctype=l&strail=false&bcs=d&nselm=h&met_y=sp_dyn_le00_in&scale_y=lin&ind_y=false&rdim=world&idim=country:USA&ifdim=world&hl=fr&dl=fr&ind=false.
[7] J. E. Morley, “Decreased Food Intake With Aging,” The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 56, no. Supplement 2 (October 1, 2001): 81–88, https://doi.org/10.1093/gerona/56.suppl_2.81.
[8] Anna Pilgrim et al., “An Overview of Appetite Decline in Older People,” Nursing Older People 27, no. 5 (June 2015): 29–35, https://doi.org/10.7748/nop.27.5.29.e697.
[9] Lorenzo M. Donini, Claudia Savina, and Carlo Cannella, “Eating Habits and Appetite Control in the Elderly: The Anorexia of Aging,” International Psychogeriatrics 15, no. 1 (March 2003): 73–87, https://doi.org/10.1017/S1041610203008779.
[10] Riccardo Calvani et al., “Current Nutritional Recommendations and Novel Dietary Strategies to Manage Sarcopenia,” The Journal of Frailty & Aging 2, no. 1 (2013): 38–53.
[11] Thara Govindaraju et al., “Dietary Patterns and Quality of Life in Older Adults: A Systematic Review,” Nutrients 10, no. 8 (July 26, 2018), https://doi.org/10.3390/nu10080971.
[12] karine Pierre-Lecocq, “Aliment fonctionnel,” CERIN, accessed April 9, 2020, https://www.cerin.org/glossaire/aliment-fonctionnel/.
[13] Institute of Medicine (US) Food Forum, Nutrition Concerns for Aging Populations, Providing Healthy and Safe Foods As We Age: Workshop Summary (National Academies Press (US), 2010), https://www.ncbi.nlm.nih.gov/books/NBK51837/.
[14] Natalia Ubeda, María Achón, and Gregorio Varela-Moreiras, “Omega 3 Fatty Acids in the Elderly,” The British Journal of Nutrition 107 Suppl 2 (June 2012): 3, https://doi.org/10.1017/S0007114512001535.
[15] Benoit Smeuninx et al., “Age-Related Anabolic Resistance of Myofibrillar Protein Synthesis Is Exacerbated in Obese Inactive Individuals,” The Journal of Clinical Endocrinology and Metabolism 102, no. 9 (July 14, 2017): 3535–45, https://doi.org/10.1210/jc.2017-00869.
[16] Imanipour Vahid et al., “The Effects of Branch-Chain Amino Acids on Fatigue in the Athletes,” Interventional Medicine & Applied Science 10, no. 4 (n.d.): 233–35, https://doi.org/10.1556/1646.10.2018.10.
[17] Joshua C. Anthony et al., “Orally Administered Leucine Stimulates Protein Synthesis in Skeletal Muscle of Postabsorptive Rats in Association with Increased EIF4F Formation,” The Journal of Nutrition 130, no. 2 (February 1, 2000): 139–45, https://doi.org/10.1093/jn/130.2.139.
[18] Christos S. Katsanos et al., “A High Proportion of Leucine Is Required for Optimal Stimulation of the Rate of Muscle Protein Synthesis by Essential Amino Acids in the Elderly,” American Journal of Physiology. Endocrinology and Metabolism 291, no. 2 (August 2006): E381-387, https://doi.org/10.1152/ajpendo.00488.2005.
[19] Hope Barkoukis, “Nutrition Recommendations in Elderly and Aging,” The Medical Clinics of North America 100, no. 6 (November 2016): 1237–50, https://doi.org/10.1016/j.mcna.2016.06.006.
[20] Ann Ödlund Olin et al., “Energy-Enriched Hospital Food to Improve Energy Intake in Elderly Patients,” Journal of Parenteral and Enteral Nutrition 20, no. 2 (1996): 93–97, https://doi.org/10.1177/014860719602000293.
[21] Issa Narchi et al., “Emotions Generated by Food in Elderly French People,” The Journal of Nutrition, Health & Aging 12 (February 1, 2008): 626–33, https://doi.org/10.1007/BF03008273.
[22] M. Laureati et al., “Sensory Acceptability of Traditional Food Preparations by Elderly People,” Food Quality and Preference, The First European Conference on Sensory Science of Food and Beverages: “A Sense of Identity,” 17, no. 1 (January 1, 2006): 43–52, https://doi.org/10.1016/j.foodqual.2005.08.002.
[23] E. Rothenberg and K. Wendin, “7 – Texture Modification of Food for Elderly People,” in Modifying Food Texture, ed. Jianshe Chen and Andrew Rosenthal (Woodhead Publishing, 2015), 163–85, https://doi.org/10.1016/B978-1-78242-334-8.00007-9.
Webinaire Healthy Ageing : la demande croissante en protéines sur le marché des séniors
Elsa Trotier, Chef Produit responsable de la gamme des protéines nutritionnelles et Wenqian Sun, Spécialiste Applications, aborderont lors d’un webinaire gratuit, la demande croissante en protéines sur le marché des séniors.
De nos jours, la population est vieillissante, en 2050, 2 milliards de la population auront plus de 60 ans (WHO). Pour accompagner cette population vieillissante, de nombreux produits ont été lancé sur le marché de la nutrition des seniors. Beaucoup d’entre eux contiennent des protéines. Les seniors souhaitent des produits avec une texture agréable et pratiques à consommer.
Face à cette problématique, Ingredia propose des solutions pour répondre aux besoins nutritionnels et un support technique lors du développement de votre produit avec notre gamme de protéines de lait nutritionnelles PRODIET®.
Découvrez en plus, en participant à notre webinaire Mardi 24 novembre, à 13h45.
Inscrivez-vous ici !

En quoi les protéines sont-elle bénéfiques pour la santé osseuse ?
Tout au long de notre vie, nos capacités physiques évoluent : elles augmentent progressivement avec l’âge jusqu’à atteindre leur maximum entre 20 et 30 ans1 puis, à la suite d’une phase de stagnation, survient une phase de déclin.2 Le début de cette phase dépend de nombreux facteurs, notamment la génétique, l’alimentation, l’activité sportive, ainsi que l’état de santé global.3 Avec l’âge, certaines complications peuvent surgir notamment au niveau osseux. Après 50 ans, il n’est en effet pas rare d’observer une fragilisation progressive des os : c’est l’ostéopénie.
L’ostéopénie ? Quelle différence y a-t-il avec l’ostéoporose dont on entend régulièrement parler ?
Comme le montre la figure 1, il est possible de simplifier l’évolution de la dégradation de la santé osseuse en 3 étapes. Avant 50 ans, la densité minérale est globalement normale, les os sont solides. Puis les premières complications s’installent : les os commencent à se fragiliser et le risque de fracture augmente. C’est l’ostéopénie. A ce stade, l’objectif est de faire en sorte de renforcer sa masse osseuse afin de retarder au maximum l’ostéoporose, voire même de retrouver une bonne santé osseuse. Si rien n’est fait, le squelette va continuer à se dégrader : on assiste alors à une déminéralisation osseuse caractéristique de l’ostéoporose (figure 2).4
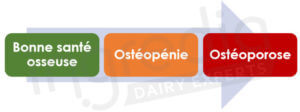
Figure 1 : Evolution de la dégradation de la santé osseuse chez l’Homme à partir de 50 ans.5
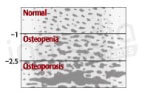
Figure 2 : Evaluation de la densité osseuse en fonction du score de densité osseuse. Plus ce score est bas, plus les os sont poreux et donc fragilisés.6
Est-ce que ces complications concernent tout le monde ?
Oui, avec l’âge, il est parfaitement naturel d’observer une santé osseuse en régression. Cependant, certains facteurs peuvent potentiellement augmenter le risque de survenu de ces complications : le genre (en moyenne, durant leur vie, plus de la moitié des femmes seront atteintes d’une fracture ostéoporotique contre seulement un tiers des hommes)7, l’exposition à certaines substances nocives (alcool, cigarette), l’alimentation et l’activité physique.8
Est-il donc possible de réduire le risque de fragilisation osseuse en agissant sur notre mode de vie ?
Exactement, et nous allons en particulier nous pencher sur l’alimentation. Il est en effet connu que le calcium et la vitamine D sont absolument indispensables afin d’assurer une bonne santé osseuse. C’est ainsi qu’à partir de l’âge de 50 ans, les apports journaliers recommandés sont de 1200mg/j pour le calcium, et 10µg/j pour la vitamine D.9
Néanmoins, ce ne sont pas les deux seuls nutriments nécessaires à considérer. En effet, une étude du « Current Osteoporosis Report » a démontré que de nombreux nutriments (figure 3) comme par exemple les protéines, affectent positivement la santé osseuse.10
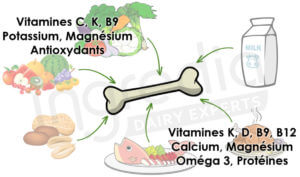
Figure 3 : Nutriments agissant positivement sur la santé osseuse.10
Les protéines seraient bénéfiques pour les os ? Je pensais pourtant que c’était l’inverse…
Il s’agit d’une idée reçue. Avant de démontrer leurs effets bénéfiques sur la santé osseuse, il a d’abord été observé que la consommation de protéines entraînait une augmentation de la concentration en calcium dans les urines. Ainsi, nous avons, dans un premier temps, pensé que les protéines seraient néfastes pour les os puisqu’elles entraîneraient une déminéralisation osseuse.11
Or cette conclusion était bien trop hâtive : en effet, bien qu’une consommation accrue de protéines augmente la sécrétion de calcium par voie urinaire, elles augmentent également l’absorption de ce dernier au niveau intestinal. Et ceci a notamment été prouvé au cours d’une étude de 2003 publiée dans le « American Journal of Clinical Nutrition ». Comme le montre la figure 4, une alimentation riche en protéines (2,1g/kg de masse corporelle) permet d’atteindre une absorption intestinale du calcium de 26,3% contre seulement 18,4% pour une alimentation faible en protéines (0,7g/kg de masse corporelle). Ceci représente une augmentation non négligeable de l’absorption du calcium de 43%.12 13
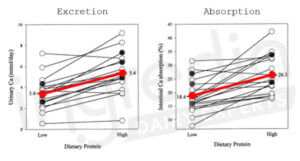
Figure 4 : Changements individuels de la concentration urinaire de calcium et de l’absorption intestinale de calcium sur 24h en réponse à une alimentation « faible » (0,7g/kg) et « élevée » (2,1g/kg) en protéines chez 20 femmes en bonne santé.12 13
D’après la figure 4, la diète « élevée » en protéines (2,1g/kg) entraîne une augmentation de l’excrétion du calcium par voie urinaire de 2 mmol sur 24h (3,4 à 5,4 mmol/j).
Connaissant l’apport journalier de calcium dans la diète imposée lors de l’étude (20 mmol/j), il est possible d’en déduire la quantité absorbée avec la diète « faible » (0,7g/kg) et la diète « élevée » (2,1g/kg) en protéines : 3,7mmol avec la première (18,4% de 20mmol), et 5,3mmol avec la seconde (26,3% de 20mmol). Par conséquent, cette dernière a permis d’absorber 1,6mmol de calcium supplémentaire sur 24h.12
Ainsi, la majeure partie de l’augmentation de l’excrétion du calcium s’explique par une augmentation de son absorption au niveau intestinal.
Mais il n’y a pas que l’excrétion du calcium : on raconte que les protéines sont considérées comme « acides » pour l’organisme et le placent donc dans des conditions favorables à la déminéralisation osseuse. Est-ce vrai ?
Il est vrai que l’on considère souvent les protéines comme étant « acides » pour l’organisme, en opposition aux fruits et légumes considérés comme « alcalins ». Mais est-ce qu’une alimentation « acide » ou « alcaline » a un impact sur la santé osseuse ? Ceci a été l’objet d’une analyse menée en 2013 par Hanley et Whiting qui ont compilé les résultats de différentes études sur le sujet. Ils ont ainsi conclu que les preuves soutenant le rôle des protéines dans le développement de l’ostéoporose ne sont pas cohérentes et que, parallèlement, une diète plus « alcaline » n’apparaît pas particulièrement plus bénéfique pour la santé osseuse.14
Pour résumer cette review, il n’existe aucun lien entre la santé osseuse et une alimentation « acide » ou « alcaline ».

Très bien, mais alors en quoi les protéines affectent la santé osseuse ? Les os ne sont pourtant pas constitués de protéines…
Et bien si : contrairement à une idée populaire selon laquelle les os sont constitués de matière inerte, ceux-ci contiennent des protéines et en particulier du collagène.15 Comme toutes les protéines, elles se dégradent et se regénèrent perpétuellement : c’est le turn-over protéique, qui a notamment été vu plus en profondeur dans notre article de blog « Pourquoi les athlètes d’endurance ont-ils besoin de plus de protéines ? ». Par conséquent, un apport accru de protéines par l’alimentation permet d’assurer correctement ce turn-over protéique et préserve donc la santé osseuse.
Mais ce n’est pas tout puisqu’une review de 2011 suggère que les protéines alimentaires pourraient agir sur différents mécanismes de notre organisme et ainsi avoir un impact positif sur la santé osseuse16 :
- En améliorant l’absorption intestinale du calcium comme nous l’avons vu précédemment.12
- En réprimant la parathormone, une hormone favorisant l’ostéolyse (déminéralisation osseuse) lorsque sa concentration est trop importante. A l’inverse, à faible dose, cette hormone soutient la reminéralisation osseuse. Sa répression est donc positive pour la santé osseuse.17
- En augmentant la production d’IGF-1, une hormone contribuant positivement à la minéralisation osseuse.18
- En augmentant la masse musculaire, protégeant ainsi mieux les os et réduisant le risque de chute et donc de fracture. Une étude de cohorte de 5 ans achevée en 2009 a notamment démontré le lien positif entre l’augmentation de la masse musculaire et la santé osseuse chez les personnes âgées.19
Quels sont donc les aliments à privilégier pour assurer une bonne santé osseuse ?
La réponse est simple : il faut des aliments sources de protéines, de vitamines (et en particulier de vitamine D) et de minéraux (calcium, magnésium, potassium). L’idéal est alors de sélectionner des aliments contenant les protéines les plus complètes possible, donc riches en acides aminés essentiels A.
C’est pourquoi le lait et les produits laitiers constituent d’excellents aliments préservant la santé osseuse. En effet, comme nous l’avons détaillé dans notre article « Comment définir la qualité d’une protéine ? » les protéines du lait sont une bonne source d’acides aminés essentiels. Par ailleurs, les minéraux du lait et notamment le calcium sont particulièrement biodisponibles B.20 21 Enfin les produits laitiers contiennent de nombreuses vitamines, telles que la D, K, B9 et B12, indispensables pour les os de notre organisme.22
Ainsi, il est primordial d’apporter des aliments riches en nutriments essentiels à la santé osseuse pour les populations les plus à risque, notamment les seniors et personnes âgées. Comme nous l’avons vu au cours de cet article ou même dans de précédents tel que « Quelles sont les protéines les plus adaptées pour répondre aux besoins des personnes âgées ? », le lait et les protéines laitières peuvent constituer un élément de choix pour répondre à cette demande.
*A [Acide aminé essentiel] : Acide aminé que l’organisme n’est pas capable de synthétiser et qu’il est indispensable d’apporter par l’alimentation
*B [Biodisponible] : relatif à l’absorption et l’utilisation d’un élément par l’organisme. Plus un nutriment est biodisponible, plus celui-ci est absorbé et utilisé par l’organisme.
Pour plus d’informations, n’hésitez pas à nous contacter.
Auteurs : Rémi Maleterre & Audrey Boulier.
________________________________________________________________________________________________
[1] David B. Burr, “Muscle Strength, Bone Mass, and Age-Related Bone Loss,” Journal of Bone and Mineral Research 12, no. 10 (1997): 1547–51, https://doi.org/10.1359/jbmr.1997.12.10.1547.
[2] Douglas Paddon-Jones and Blake B. Rasmussen, “Dietary Protein Recommendations and the Prevention of Sarcopenia,” Current Opinion in Clinical Nutrition and Metabolic Care 12, no. 1 (January 2009): 86–90, https://doi.org/10.1097/MCO.0b013e32831cef8b.
[3] Taylor J. Marcell, “Review Article: Sarcopenia: Causes, Consequences, and Preventions,” The Journals of Gerontology: Series A 58, no. 10 (October 1, 2003): M911–16, https://doi.org/10.1093/gerona/58.10.M911.
[4] David L. Glaser and Frederick S. Kaplan, “Osteoporosis. Definition and Clinical Presentation,” Spine 22, no. 24 Suppl (December 15, 1997): 12S-16S, https://doi.org/10.1097/00007632-199712151-00003.
[5] “Osteoporosis vs Osteopenia: Know the Difference,” OrthoAtlanta, accessed February 27, 2020, https://www.orthoatlanta.com/media/osteoporosis-vs-osteopenia-know-the-difference.
[6] Harvard Health Publishing, “Osteopenia: When You Have Weak Bones, but Not Osteoporosis,” Harvard Health, accessed February 27, 2020, https://www.health.harvard.edu/womens-health/osteopenia-when-you-have-weak-bones-but-not-osteoporosis.
[7] Philip D. Ross, “Osteoporosis: Frequency, Consequences, and Risk Factors,” Archives of Internal Medicine 156, no. 13 (July 8, 1996): 1399–1411, https://doi.org/10.1001/archinte.1996.00440120051005.
[8] Farkhondeh Pouresmaeili et al., “A Comprehensive Overview on Osteoporosis and Its Risk Factors,” Therapeutics and Clinical Risk Management 14 (November 6, 2018): 2029–49, https://doi.org/10.2147/TCRM.S138000.
[9] John A. Sunyecz, “The Use of Calcium and Vitamin D in the Management of Osteoporosis,” Therapeutics and Clinical Risk Management 4, no. 4 (August 2008): 827–36, https://doi.org/10.2147/tcrm.s3552.
[10] Shivani Sahni et al., “Dietary Approaches for Bone Health: Lessons from the Framingham Osteoporosis Study,” Current Osteoporosis Reports 13, no. 4 (August 2015): 245–55, https://doi.org/10.1007/s11914-015-0272-1.
[11] Jane E. Kerstetter and Lindsay H. Allen, “Protein Intake and Calcium Homeostasis,” in Nutrition and Osteoporosis, ed. Harold H. Draper, vol. 9, Advances in Nutritional Research (Boston, MA: Springer US, 1994), 167–81, https://doi.org/10.1007/978-1-4757-9092-4_10.
[12] Jane E. Kerstetter, Kimberly O. O’Brien, and Karl L. Insogna, “Dietary Protein, Calcium Metabolism, and Skeletal Homeostasis Revisited,” The American Journal of Clinical Nutrition 78, no. 3 (September 1, 2003): 584S-592S, https://doi.org/10.1093/ajcn/78.3.584S.
[13] J. E. Kerstetter, K. O. O’Brien, and K. L. Insogna, “Dietary Protein Affects Intestinal Calcium Absorption,” The American Journal of Clinical Nutrition 68, no. 4 (October 1998): 859–65, https://doi.org/10.1093/ajcn/68.4.859.
[14] David A. Hanley and Susan J. Whiting, “Does a High Dietary Acid Content Cause Bone Loss, and Can Bone Loss Be Prevented with an Alkaline Diet?,” Journal of Clinical Densitometry: The Official Journal of the International Society for Clinical Densitometry 16, no. 4 (December 2013): 420–25, https://doi.org/10.1016/j.jocd.2013.08.014.
[15] Bach Quang Le et al., “The Components of Bone and What They Can Teach Us about Regeneration,” Materials 11, no. 1 (December 22, 2017): 14, https://doi.org/10.3390/ma11010014.
[16] Jane E. Kerstetter, Anne M. Kenny, and Karl L. Insogna, “Dietary Protein and Skeletal Health: A Review of Recent Human Research,” Current Opinion in Lipidology 22, no. 1 (February 2011): 16–20, https://doi.org/10.1097/MOL.0b013e3283419441.
[17] G. Lombardi et al., “The Roles of Parathyroid Hormone in Bone Remodeling: Prospects for Novel Therapeutics,” Journal of Endocrinological Investigation 34, no. 7 Suppl (July 2011): 18–22.
[18] J. P. Bonjour et al., “Protein Intake and Bone Growth,” Canadian Journal of Applied Physiology = Revue Canadienne De Physiologie Appliquee 26 Suppl (2001): S153-166, https://doi.org/10.1139/h2001-050.
[19] Xingqiong Meng et al., “A 5-Year Cohort Study of the Effects of High Protein Intake on Lean Mass and BMC in Elderly Postmenopausal Women,” Journal of Bone and Mineral Research: The Official Journal of the American Society for Bone and Mineral Research 24, no. 11 (November 2009): 1827–34, https://doi.org/10.1359/jbmr.090513.
[20] Elizabeth F. Buzinaro, Renata N. Alves de Almeida, and Gláucia M. F. S. Mazeto, “[Bioavailability of dietary calcium],” Arquivos Brasileiros De Endocrinologia E Metabologia 50, no. 5 (October 2006): 852–61, https://doi.org/10.1590/s0004-27302006000500005.
[21] Léon Guéguen and Alain Pointillart, “The Bioavailability of Dietary Calcium,” Journal of the American College of Nutrition 19, no. sup2 (April 1, 2000): 119S-136S, https://doi.org/10.1080/07315724.2000.10718083.
[22] Frédéric Gaucheron, “Milk and Dairy Products: A Unique Micronutrient Combination,” Journal of the American College of Nutrition 30, no. 5 Suppl 1 (October 2011): 400S-9S, https://doi.org/10.1080/07315724.2011.10719983.
Les protéines, un ingrédient clé dans les produits de gestion du poids
Plus de 2 millards de personnes sont actuellement en surpoids dans le monde, et ce chiffre augmente d’année en d’année.1 Le surpoids correspond à un IMC* supérieur ou égal à 25, tandis que l’obésité se définit par un IMC* supérieur ou égal à 30.1
Le surpoids est communément connu pour être un facteur de risque de maladies (par exemple cardiovasculaires et musculo-squelettiques), et de cancers.1
Plus de 80 % des adolescents ne sont pas suffisamment actifs physiquement.1 2 Un rythme de vie sédentaire a un impact sur leurs habitudes de vie, et sur leur santé. Une étude sur des adolescents de 13-14 ans évaluant les facteurs de risque liés au surpoids a montré qu’en fonction de l’origine sociale et du genre, le temps passé devant un écran, sauter son petit-déjeuner et ne pas pratiquer d’activité sportive pouvaient être corrélés avec la prise de poids.3 Le surpoids et l’obésité chez les adolescents est un enjeu de santé publique, car ces catégories de population ont de forts risques de développer des maladies chroniques à l’âge adulte.1

Les consommateurs se préoccupent-ils de leur poids ?
Une étude montre que 48 % de la population mondiale s’inquiète d’être en surpoids dans les années à venir (Euromonitor International, 2020). Aujourd’hui, la population générale a conscience des risques pouvant découler d’une prise de poids excessive et s’inquiète pour sa santé, en particulier son bien-être. Une étude biennale a montré qu’un taux plus élevé de personnes a cherché à perdre du poids en 2015-2016 par rapport à 2007-2008 (ceci correspond à 50 % de la population Américaine adulte).4
De plus, avec l’arrivée de l’été, bon nombre de personnes souhaitent perdre du poids. Les consommateurs veulent se sentir émotionnellement et physiquement en accord avec leur corps.

Quelles catégories de produits peut-on retrouver pour gérer son poids ?
Deux catégories de produits sont positionnées sur le marché de la gestion du poids.
- La première catégorie correspond aux produits dits de gestion du poids. Ils sont destinés aux personnes souhaitant perdre du poids sans forcément adopter une activité physique. Ces produits peuvent avoir les caractéristiques suivantes : substitution partielle ou complète de repas, diminution de calories pour favoriser la perte de poids. De plus, ils sont souvent riches en protéines et en fibres. Cependant, le marché des produits de gestion du poids tend à rester constant et à même décroître (Mintel, 2019).
- La seconde catégorie correspond aux produits de nutrition active.
Les consommateurs s’intéressent de plus en plus à ces produits en les couplant avec une activité physique régulière. Cette nouvelle tendance consommateur est traitée plus loin dans cet article.
Quels produits de gestion du poids existe-t-il ?
Depuis un an, des substituts de repas sous forme de boissons avec un claim minceur ont été lancés sur le marché des produits de gestion du poids. Les ventes représentent 55 % du marché (Figure 1).
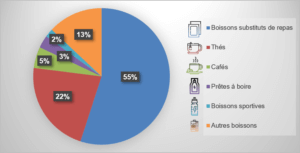
Figure 1 : Catégories de boissons avec un claim minceur (lancés entre avril 2019 et juin 2020) (Mintel, 2020)
La plus forte demande en boissons « substituts de repas » se situe en Asie (49 % des ventes) (Euromonitor, 2020).
Au global, la majorité des boissons avec un claim minceur contiennent des protéines (74 %, dont 38 % contiennent plus de 10 % de protéines) (Figure 2).
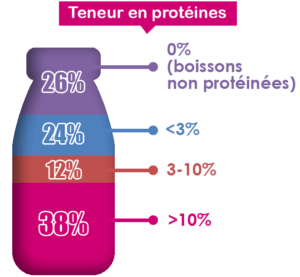
Figure 2 : Répartition des teneurs en protéines des boissons avec un claim minceur (Mintel, 2020)
Le reste du marché de la gestion du poids est représenté par 45 % de produits hors boissons (barres, céréales de petit-déjeuner, produits de boulangerie …). 88 % de ces produits contiennent des protéines.
Il semble qu’une grande part des produits minceur contiennent des protéines. Qu’en pensent les consommateurs ?
Bon nombre de consommateurs ayant pour objectif de perdre du poids portent une attention particulière au contenu de leur régime alimentaire. Certains augmentent leur consommation en protéines en suivant des régimes hyperprotéinés (Figure 3).
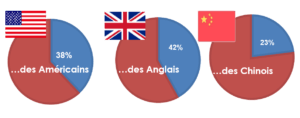
Figure 3 : Augmentation de la prise de protéines dans le but de perdre du poids en Amérique, Grande-Bretagne et Chine (Mintel, 2016)
Par ailleurs, 70 % de la population globale reconnait l’importance d’une consommation journalière suffisante de protéines (FMCG Gurus, 2018).
Pourquoi les protéines sont-elles une composante clé dans la gestion du poids ?
Les protéines sont majoritairement utilisées pour les fonctions suivantes :
- Augmentation de la satiété ; ceci va aider au maintien du poids en aidant à réduire les grignotages.5 6
- Augmentation des dépenses énergétiques.5
- Gain de masse musculaire ; les protéines sont riches en acides aminés essentiels, notamment en leucine, qui favorise la synthèse musculaire. Les protéines permettent également de réduire les pertes de masse corporelle maigre.5 7
Les protéines de lait ayant un excellent profil en acides aminés, elles sont bien adaptées aux régimes alimentaires de gestion du poids.
Pour plus d’informations sur les effets bénéfiques des protéines dans la gestion du poids, nous vous invitons à vous référer à nos deux précédents articles s’intitulant “En quoi les protéines peuvent-elles présenter un intérêt dans la gestion du poids ?” et “En quoi les protéines laitières présentent-elles un intérêt particulier pour la gestion du poids ?”.
Comme mentionné précédemment, le marché de la gestion du poids tend à stagner. Cela est dû à la demande en nutrition active grandissante par rapport aux produits de gestion du poids.

Pourquoi les consommateurs délaissent-ils les produits de gestion du poids pour se tourner vers la nutrition active ?
La nutrition active fait partie intégrante de la nutrition sportive. Les ventes en nutrition sportive montrent qu’il s’agit d’un marché prometteur, avec des ventes mondiales de 12.7 millions de dollars en 2018, et une croissance de +8.4 % (CAGR 2018-2023) (Euromonitor International, 2020).
La nutrition active peut se définir comme étant un “choix de style de vie sain avec pour objectif principal l’optimisation des performances physiques et mentales”.8
Par le passé, les produits étaient spécialisés en gestion du poids et ciblaient les personnes en surpoids. De nos jours, bon nombre de consommateurs veulent maintenir leur poids et rester en forme, d’autant plus que le sport et la nutrition sont aujourd’hui reconnus comme étant des piliers du bien-être. Les consommateurs recherchent des nutriments fonctionnels dans leur alimentation, tels que les protéines. 32 % des adultes âgés de 45-54 ans considèrent que se maintenir en forme fait partie de leur identité.9
Les produits lancés sur le marché de la nutrition active sont généralement “prêts à consommer” (on-the-go), comme les produits “prêts à boire” (ready-to-drink), les barres hyperprotéinées et les shakes.

La perte de poids est-elle une composante clé de la nutrition sportive ?
La perte de poids est clé en marketing de la nutrition sportive avec les produits hyperprotéinés, en particulier les boissons. Une étude d’Euromonitor (2019) montre que les motivations de consommation de ces produits diffèrent chez les hommes et les femmes. 36 % des femmes et 26 % des hommes consomment des produits nutritionnels dans le but de perdre du poids. 37 % des femmes et 45 % des hommes cherchent à augmenter leur force et leur tonicité musculaire. Ainsi, les femmes tendent à rechercher la perte de poids plus que les hommes, ces derniers trouvant l’augmentation de la tonicité musculaire plus importante. Des slogans comme “strong is the new skinny**” apparaissent sur les packagings.10

J’ai besoin de prendre du poids. Consommer des protéines me sera-t-il également bénéfique ?
Hormis les souhaits de perdre du poids ou gagner de la tonicité musculaire, certaines personnes peuvent à l’inverse avoir besoin de prendre du poids. C’est le cas par exemple des seniors et des personnes dénutries. Il est recommandé de consommer des boissons hyperprotéinées avec une teneur nutritionnelle élevée afin de maintenir un poids sain et pour prévenir l’apparition de maladies, telles que la sarcopénie.

Pour conclure, les protéines sont un ingrédient clé pour gérer son poids. Elles peuvent être utilisées pour perdre, maintenir ou gagner du poids pour se maintenir en bonne santé. Aujourd’hui, la gestion du poids concerne tout type de consommateur. Les aliments hyperprotéinés, notamment les boissons, en sont un excellent allié.
Pour plus d’informations et pour toute demande, Contactez-nous.
Auteurs : Sandrine Tran & Elsa Trotier.
*IMC : Indice de Masse Corporelle.
** La nouvelle minceur, c’est être forte.
________________________________________________________________________________________________
[1] WHO, 2020. Obesity and overweight. https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight (consulted on 06.18.2020)
[2] WHO, 2019. To grow up healthy, children need to sit less and play more. https://www.who.int/news-room/detail/24-04-2019-to-grow-up-healthy-children-need-to-sit-less-and-play-more (consulted on 06.18.2020)
[3] Guignon N., et al., 2019. En 2017, des adolescents plutôt en meilleure santé physique mais plus souvent en surcharge pondérale. Direction de la recherche, des études, de l’évaluation et des statistiques. Volume 1122, August 2019. Pages 1-6. https://drees.solidarites-sante.gouv.fr/IMG/pdf/er1122.pdf (consulted on 06.18.2020)
[4] Euromonitor, 2018. Passport, New Visions of Weight Management: A 2018 Update on Trends and Innovations.
[5] Paddon-Jones, E. Westman, R.D. Mattes, R.R. Wolfe, A. Astrup, M. Westerterp-Plantenga, 2008. Protein, weight management, and satiety. The American Journal of Clinical Nutrition, Volume 87, Issue 5, May 2008, Pages 1558S–1561S. Pub May 01, 2008. https://doi.org/10.1093/ajcn/87.5.1558S (consulted on 17.06.2020)
[6] Soenen S., Westerterp-Plantenga, Margriet S., 2008. Proteins and satiety: implications for weight management. Clinical Nutrition and Metabolic Care. Vol 11:6, 747-751. Pub November 2008. https://doi.org/10.1097/MCO.0b013e328311a8c4 (consulted on 17.06.2020)
[7] Tappy, 1996. Thermic effect of food and sympathetis nervous system activity in humans. Reprod Nutr Dev. 36(4):391-7. Pub 1996.
[8] Euromonitor International, 2016. Passport. What is “Active Nutrition” and how can health and wellness players leverage the concept?
[9] Mintel, 2019. Optimum nutrition launches products geared towards adults 40%.
[10] Euromonitor, December 2018. Passport, New Visions of Weight Management: A 2018 Update on Trends and Innovations.
En quoi les produits laitiers peuvent-ils substituer les produits carnés ?
Tant pour des raisons environnementales, économiques, que de santé, la tendance alimentaire est aujourd’hui à la réduction de la consommation de viande. Depuis de nombreuses années, plusieurs modes d’alimentation comprenant peu voire pas de viande sont très en vogue : pour ne citer que les plus courants, nous avons le flexitarisme (réduction forte de la consommation de viande), le végétarisme (exclusion de la viande), ou encore le végétalisme (exclusion de tout produit d’origine animale). Ainsi, d’après une étude du Credoc de 2018, la consommation de produits carnés a baissé de 12% en France en seulement 10 ans.1
Cependant, pour nombre d’entre nous, la viande est ou était notre source principale de protéines. Il a donc été nécessaire de se tourner vers différentes alternatives pour pouvoir couvrir ses besoins nutritionnels. C’est ainsi que les produits laitiers peuvent constituer des substituts de choix pour les flexitariens et les végétariens !
Les produits laitiers sont-ils une bonne source de protéines ?
Pour répondre à cette question, le meilleur moyen est de consulter une table de composition nutritionnelle des aliments telle que la table Ciqual de l’ANSES.2 Les données de la figure 1 sont ainsi tirées de cette base de données.

Figure n°1 : Quantité de protéines dans différentes portions de produits laitiers.2
Comparons les données de la figure 1 avec celles d’un produit carné, par exemple un steak haché de bœuf de 100g : celui-ci contient entre 20 et 25g de protéines. Une part de camembert (6,3g de protéines) accompagnée d’un bol de 200g de fromage blanc (16g de protéines) permet d’apporter 22,3g de protéines, soit autant que ce steak haché de bœuf. Les produits laitiers sont ainsi de bonnes sources de protéines pour remplacer les viandes.2
Les protéines laitières sont-elles de bonne qualité ?
Oui, il s’agit de protéines d’excellente qualité qui, comme celles des viandes ou poissons, comportent l’ensemble des acides aminés composant les protéines de notre organisme. Comme le montre la figure 2 issue d’un article du Journal of Nutrition de 2015, elles contiennent tous les acides aminés essentiels A en bonnes proportions : avec 52g/100g de protéines, les protéines solubles du lait (whey) sont les plus riches en acides aminés essentiels. Les caséines se situent quant à elle en seconde position (48g/100g) devant le bœuf ou les œufs (44g/100g).3
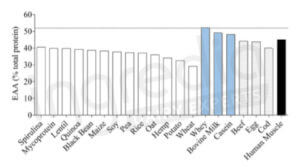
Figure n°2 : Concentration en Acides aminés essentiels (EAA) de différentes sources de protéines.3
Les barres blanches correspondent aux protéines d’origine végétale, les bleues aux protéines laitières, les grises aux autres protéines animales (viande, poisson et œuf) et la noire aux protéines musculaires de l’Homme. La ligne horizontale en pointillée représente la concentration en acides aminés essentiels la plus haute relevée durant l’étude, à savoir celle des protéines solubles du lait (whey protein).
Est-ce que tous les acides aminés essentiels sont aussi importants ?
Oui, puisque par définition un acide aminé essentiel ne peut pas être synthétisé par l’organisme. Le manque de n’importe quel acide aminé essentiel aura donc des conséquences néfastes sur l’organisme.
Néanmoins, parmi ceux-ci, il existe un acide aminé tout particulièrement important pour stimuler au mieux la synthèse protéique musculaire : il s’agit de la Leucine. Ceci peut être tout particulièrement intéressant pour les sportifs ou même les seniors et personnes âgées.3 4 5 Pour plus d’informations sur l’intérêt de la Leucine pour stimuler l’anabolisme B, consultez notre article « Quelles sont les protéines les adaptées pour répondre aux besoins des seniors ? ».
La figure 3 représente la teneur en Leucine de différentes sources de protéines. On remarque alors que les protéines laitières sont les meilleures sources de Leucine (11,7% pour le whey et 9,2% pour les caséines*). Il s’agit donc de protéines parfaitement adaptées aux personnes souhaitant maintenir ou renforcer leur masse musculaire.3
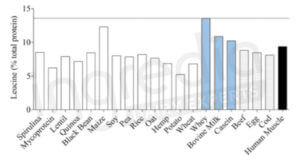
Figure n°3 : Concentration en Leucine de différentes sources de protéines.3
La teneur en acides aminés essentiels est-elle le seul paramètre à prendre en compte pour juger de la qualité d’une protéine ?
Non, il existe un indicateur qui permet d’évaluer la qualité d’une protéine : il s’agit du DIAAS (Digestible Indispensable Amino Acid Score). Pour une protéine donnée, celui-ci prend en compte la composition en acides aminés essentiels ainsi que la digestibilité C de chacun.6 7 Pour plus d’information au sujet de cet indicateur, n’hésitez pas à consulter notre article dédié à la qualité des protéines.
D’après la figure 4 dont les données sont tirées d’une étude menée par S. Phillips en 2017, le lait entier a un DIAAS d’environ 1,14. En comparaison, le blanc de poulet a un DIAAS de 1,08 et la viande de bœuf se situe aux alentours de 1,0 (le DIAAS dépendant de la digestibilité de chaque acide aminé essentiel de la protéine, le mode de cuisson du produit carné peut influencer cette valeur).8 9 Plus un aliment a un DIAAS élevé, plus les protéines qu’il contient sont digestes et correspondent aux besoins nutritionnels. Par conséquent, on remarque que les protéines laitières peuvent représenter un excellent substitut aux produits carnés.
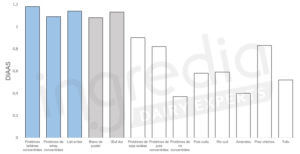
Figure n°4 : DIAAS de différents aliments et ingrédients.8
Les barres blanches correspondent aux protéines d’origine végétale, les bleues aux protéines laitières et les grises aux autres protéines d’origine animale (viande et œuf).
Par ailleurs, la figure 4 met en évidence les deux principaux inconvénients des protéines d’origine végétales : d’une part elles sont généralement incomplètes et d’autres part elles sont moins digestes. Ceci explique pourquoi ces protéines ne dépassent jamais le DIAAS de 1,0. Par exemple, les protéines de riz manquent de Lysine et de Thréonine, deux acides aminés essentiels que l’on retrouve globalement peu dans les céréales (en particulier la Lysine).10 Et la digestibilité des protéines de cet aliment est d’environ 55 à 65%.11 Ceci explique que le DIAAS du riz cuit se situe à seulement 0,59.12
Malgré tout, les protéines végétales restent des protéines qu’il ne faut pas négliger. Elles peuvent même surpasser les viandes sur certains points, comme le montre la figure 3 : le maïs (maize) a une teneur excellente en Leucine (12,2%) qui est près de 40% supérieure à celle des protéines de bœuf (8,8%).3 Cependant, le manque d’autres acides aminés essentiels peut limiter les effets bénéfiques de la Leucine cités précédemment. Ainsi, l’important est de toujours varier ses sources de protéines pour couvrir correctement ses besoins nutritionnels.
Par rapport aux autres protéines, seuls les avantages des protéines laitières sont présentés. Sont-elles vraiment meilleures en tout point ?
La réponse est évidemment non, il n’existe pas d’aliment parfait. Ainsi les viandes rouges conservent un avantage indéniable : leur importante teneur en fer.13 La viande rouge est ainsi une des meilleures sources de fer de l’alimentation courante, puisque 100g d’aliment cuit permettent de couvrir 18 à 26% des besoins journaliers en fer. D De son côté, le lait ne contient qu’une quantité très négligeable de fer.14
Malgré tout, les végétariens peuvent satisfaire leurs besoins en fer avec des aliments comme les lentilles. A titre comparatif, 100g de lentilles vertes cuites permettent d’assouvir 15 à 22% des besoins journaliers en fer (à noter cependant que la biodisponibilité E du fer des végétaux est moins importante que celle des viandes).2
Nota bene : L’anémie, c’est-à-dire le manque d’hémoglobine dont la cause est multiple mais souvent due à un manque de fer (carence alimentaire ou malabsorption), concerne près d’un quart de la population mondiale (1,62 milliard de personnes) selon les données relevées par l’OMS en 2008.15 Si l’on fait le choix de ne pas consommer de viande, il est donc important de surveiller sa consommation journalière de fer et de privilégier des aliments qui en apportent suffisamment (oléagineux et légumineuses) et, si besoin, d’opter pour des compléments alimentaires riches en fer (comme la Lactoferrine).
Néanmoins, en ce qui concerne les vitamines et minéraux, le lait n’est pas en reste : comme la viande de bœuf, il s’agit d’une bonne source de Phosphore, Potassium, et de vitamines B2, B5, et B12. Mais en plus de cela, le lait contient davantage de Calcium ainsi que de vitamines B1 et B9.2 13 16
Mais finalement, comment remplacer la viande lorsqu’on a l’habitude d’en avoir dans son assiette ?
Pour nombre d’entre nous, les traditions alimentaires sont ancrées dans notre culture : une assiette complète est constituée d’une viande et de ses accompagnements (légumes et féculents). Mais aujourd’hui, des produits imitant l’aspect, la texture et parfois même le goût de la viande sont apparus. Il s’agit des simili-carnés. Les plus connus sont ceux à base de protéines végétales (soja, céréales, pois chiche, …) mais il n’est pas rare que les protéines du lait viennent compléter ces analogues de la viande, notamment par l’ajout de fromage. Il est même tout à fait possible de constituer des simili-carnés entièrement à base de lait.
Pour clore cet article, il est parfaitement possible de substituer les produits carnés par une alimentation variées en produits d’origine animale (œufs et produits laitiers) et végétale (céréales, légumineuses, oléagineux) pour assurer ses besoins protéiques. Varier les sources permet d’assurer ses apports sur tous les nutriments essentiels (acides aminés, acides gras, vitamines, minéraux, …). C’est la raison pour laquelle le PNNS (Plan National Nutrition Santé) recommande un équilibre 50% protéines animales et 50% protéines végétales. Dans ce sens, les nouvelles alternatives à la viande composées de protéines végétales et de fromage apparaissent comme de très bons compromis.
Pour plus d’informations, n’hésitez pas à nous contacter.
Auteurs : Rémi Maleterre & Audrey Boulier.
*A [Acide aminé essentiel] : Acide aminé que l’organisme n’est pas capable de synthétiser et qu’il est indispensable d’apporter par l’alimentation.
*B [Anabolisme] : Synthèse des protéines musculaires.
*C [Digestibilité] : Pour un nutriment, il s’agit de la quantité ingérée effectivement disponible pour l’organisme après digestion et absorption. Elle peut être exprimée en pourcentage.
*D [Besoins journaliers en fer] : D’après l’ANSES, les besoins journaliers en fer sont de 11mg pour les hommes et les femmes ménopausées et de 16mg pour les femmes non ménopausées.
*E [Biodisponible] : relatif à l’absorption et l’utilisation d’un élément par l’organisme. Plus un nutriment est biodisponible, plus celui-ci est absorbé et utilisé par l’organisme.
*les valeurs de Leucine données correspondent à celles mesurées dans les produits Prodiet® 90S pour le whey et Prodiet® Fluid pour les caséines micellaires. Ces produits sont développés par Ingredia.
________________________________________________________________________________________________
[1] Gabriel Tavoularis and Éléna Sauvage, “Les nouvelles générations transforment la consommation de viande,” Crédoc, September 1, 2018, https://www.credoc.fr/publications/les-nouvelles-generations-transforment-la-consommation-de-viande.
[2] ANSES, “Ciqual Table de Composition Nutritionnelle Des Aliments,” accessed March 30, 2020, https://ciqual.anses.fr/.
[3] Stephan van Vliet, Nicholas A. Burd, and Luc J. C. van Loon, “The Skeletal Muscle Anabolic Response to Plant- versus Animal-Based Protein Consumption,” The Journal of Nutrition 145, no. 9 (September 2015): 1981–91, https://doi.org/10.3945/jn.114.204305.
[4] Imanipour Vahid et al., “The Effects of Branch-Chain Amino Acids on Fatigue in the Athletes,” Interventional Medicine & Applied Science 10, no. 4 (n.d.): 233–35, https://doi.org/10.1556/1646.10.2018.10.
[5] Chad M. Kerksick et al., “ISSN Exercise & Sports Nutrition Review Update: Research & Recommendations,” Journal of the International Society of Sports Nutrition 15, no. 1 (August 1, 2018): 38, https://doi.org/10.1186/s12970-018-0242-y.
[6] Food and Agriculture Organization of the United Nations, ed., Dietary Protein Quality Evaluation in Human Nutrition: Report of an FAO Expert Consultation, FAO Food and Nutrition Paper 92 (FAO Expert Consultation on Protein Quality Evaluation in Human Nutrition, FAO, 2011).
[7] Gertjan Schaafsma, “The Protein Digestibility–Corrected Amino Acid Score,” The Journal of Nutrition 130, no. 7 (July 1, 2000): 1865S-1867S, https://doi.org/10.1093/jn/130.7.1865S.
[8] Stuart M. Phillips, “Current Concepts and Unresolved Questions in Dietary Protein Requirements and Supplements in Adults,” Frontiers in Nutrition 4 (2017): 13, https://doi.org/10.3389/fnut.2017.00013.
[9] Suzanne M. Hodgkinson et al., “Cooking Conditions Affect the True Ileal Digestible Amino Acid Content and Digestible Indispensable Amino Acid Score (DIAAS) of Bovine Meat as Determined in Pigs,” The Journal of Nutrition 148, no. 10 (October 1, 2018): 1564–69, https://doi.org/10.1093/jn/nxy153.
[10] V. R. Young and P. L. Pellett, “Wheat Proteins in Relation to Protein Requirements and Availability of Amino Acids,” The American Journal of Clinical Nutrition 41, no. 5 Suppl (1985): 1077–90, https://doi.org/10.1093/ajcn/41.5.1077.
[11] Kunlun Liu, Jiabao Zheng, and Fusheng Chen, “Effect of Domestic Cooking on Rice Protein Digestibility,” Food Science & Nutrition 7, no. 2 (January 24, 2019): 608–16, https://doi.org/10.1002/fsn3.884.
[12] Brigid McKevith, “Nutritional Aspects of Cereals,” Nutrition Bulletin 29, no. 2 (2004): 111–42, https://doi.org/10.1111/j.1467-3010.2004.00418.x.
[13] ANSES, “Ciqual Table de Composition Nutritionnelle Des Aliments – La Viande Rouge, Cuite (Aliment Moyen),” accessed March 24, 2020, https://ciqual.anses.fr/#/aliments/6585/viande-rouge-cuite-(aliment-moyen).
[14] “Le Fer | Anses – Agence Nationale de Sécurité Sanitaire de l’alimentation, de l’environnement et Du Travail,” accessed March 24, 2020, https://www.anses.fr/fr/content/le-fer.
[15] Bruno De Benoist, World Health Organization, and Centers for Disease Control and Prevention (U.S.), Worldwide Prevalence of Anaemia 1993-2005 of: WHO Global Database of Anaemia (Geneva: World Health Organization, 2008), http://whqlibdoc.who.int/publications/2008/9789241596657_eng.pdf.
[16] ANSES, “Ciqual Table de Composition Nutritionnelle Des Aliments – Le Lait, Teneur En Matière Grasse Inconnue, UHT (Aliment Moyen),” accessed March 19, 2020, https://ciqual.anses.fr/#/aliments/19039/lait-teneur-en-matiere-grasse-inconnue-uht-(aliment-moyen).
Quelles sont les protéines les plus adaptées pour répondre aux besoins des seniors ?
En vieillissant, certains problèmes de santé peuvent survenir et évoluer notamment au niveau musculaire : il n’est pas rare d’observer, avec l’âge, une diminution de la force ainsi qu’une perte de masse musculaire. Dans le précédent article intitulé « quels sont les besoins protéiques des seniors et personnes âgées ? » nous insistions sur l’importance d’une consommation suffisante de protéines pour maintenir et renforcer la masse musculaire. L’objet de ce nouvel article est alors de déterminer quels sont les éléments à prendre en compte pour savoir quelles sont les protéines répondant le mieux aux besoins des seniors et personnes âgées.
Quelle est la protéine parfaite pour les seniors et les personnes âgées ?
Il n’existe pas de protéine parfaite, mais seulement des protéines plus adaptées que d’autres. Les protéines animales, notamment de part leur composition équilibrée en acides aminés essentielsA et leur excellente digestibilité, sont à privilégier par rapport aux protéines d’origine végétale. Un équilibre alimentaire reste indispensable, et il est recommandé que les protéines animales représentent au moins la moitié des apports protéiques journaliers.1 2 3
D’après un rapport de l’Initiative Internationale contre la Sarcopénie publié en 2014, les protéines laitières semblent par ailleurs être les protéines répondant le mieux aux besoins des seniors et personnes âgées.1

En quoi les protéines laitières répondent le mieux aux besoins des seniors et personnes âgées ?
Outre la composition en acides aminés et la digestibilité, une protéine doit répondre à trois critères pour être considérée comme adaptée pour supplémenter la diète des personnes âgées. Ainsi elle doit :
- contenir suffisamment d’acides aminés essentiels. En particulier les BCAAsB, et notamment la Leucine4 ;
- être facile à consommer ;
- stimuler la synthèse musculaire et favoriser durablement l’anabolisme.C 5
Les protéines laitières répondent à ces trois critères.6 7
En quoi les acides aminés essentiels et les BCAAs sont-ils si importants ?
Pour maximiser la synthèse musculaire, il est important de privilégier les protéines riches en acides aminés essentiels puisqu’ils permettent de favoriser l’anabolisme8. Les meilleures sources de protéines sont celles ayant une composition en acides aminés correspondant au moins aux besoins de l’organisme, et qui ont la meilleure digestibilité possible. Ceci est expliqué plus en détails dans l’article « Comment définir la qualité d’une protéine ? ». Un indicateur, le DIAAS, permet notamment de prendre en compte la qualité de la composition en acides aminés ainsi que la digestibilité de chacun. Plus le DIAAS est élevé, plus nous avons affaire à une protéine de haute qualité9. La figure n°1 est un diagramme en barres représentant le DIAAS en fonction de différentes sources de protéines. Il est alors possible de remarquer que les protéines laitières (casein, milk protein concentrate, whole milk powder, whey protein isolate, whey protein concentrate) sont les protéines ayant le DIAAS le plus élevé.10
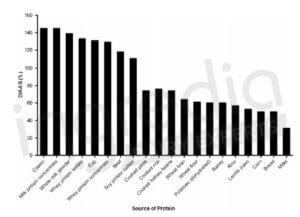
Figure n°1 : Qualité de différentes sources communes de protéines exprimée avec le DIAAS. 10
Il ne faut pas oublier que dans le cas des seniors et des personnes âgées, la prise alimentaire est globalement réduite. En conséquence, la consommation de tous les acides aminés est également réduite. Ainsi, même si les acides aminés essentiels sont à privilégier, il ne faut en aucun cas négliger les acides aminés non essentiels.
Concernant les BCAAs, ces acides aminés essentiels ont un effet positif important sur le métabolisme protéique. Ils favorisent la synthèse protéique musculaire et permettent de réduire le catabolisme.4 Parmi les 3 BCAAs, nous avons la Leucine, un des acides aminés les plus importants pour stimuler l’anabolisme.11 12
De nombreuses études ont été menées pour savoir quelle est la dose idéale de cet acide aminé pour stimuler au mieux la synthèse protéique musculaire. Une première étude de 2006 a d’abord démontré que la quantité de Leucine nécessaire pour avoir une réponse anabolique optimale chez des individus âgés d’environ 60 ans était significativement supérieure à celle nécessaire pour de jeunes adultes (respectivement 2,8g vs 1,7g).13
Une review consacrée aux recommandations nutritionnelles de la Clinique Médicale Nord Américaine évoquait quant à elle la quantité minimale de 2,2g de Leucine par prise alimentaire pour stimuler suffisamment l’anabolisme.14
Il est donc préférable de sélectionner une source de protéines riche en Leucine, telle que les protéines laitières. Les caséines micellaires contiennent par exemple 8,5% de Leucine.6 Ainsi, une dose de 30g de caséines micellaires permet d’apporter tous les acides aminés essentiels nécessaires, dont 2,6g de Leucine. Cette quantité représente une dose suffisante pour favoriser la synthèse protéique musculaire, même pour des muscles plus âgés.14
Il faut donc des protéines faciles à consommer ? Est-ce vraiment si important ?
Pour un senior ou une personne âgée, il est essentiel de favoriser les périodes d’anabolisme et de limiter autant que possible la dégradation musculaire.
De manière globale, le catabolismeD est favorisé au repos durant les périodes éloignées des repas. A l’inverse, l’anabolisme est stimulé suite à un apport protéique. Ainsi, il apparaît essentiel de consommer régulièrement des protéines au cours de la journée.15 Cependant, certaines études indiquent que le plus important reste la quantité totale de protéines consommée sur la journée et non pas le moment ou la répartition.16
En parallèle, il faut prendre en compte que l’appétit diminue souvent avec l’âge. En conséquence, la quantité d’aliments ingérée diminue en moyenne de 25% entre l’âge de 40 et 70 ans. C’est une des raisons expliquant pourquoi 15 à 38% des personnes âgées dépendantes (c’est-à-dire les personnes en EHPAD ou assistés par une infirmière à domicile suite à leur perte d’autonomie) sont touchées par la dénutrition en France.17
Ainsi, il peut être intéressant d’étaler les prises alimentaires sur la journée et surtout de choisir une source de protéines facile à consommer, par exemple sous la forme d’une boisson ou crème dessert. Les protéines laitières, en particulier les caséines micellaires, sont parfaitement adaptées pour ce type de formulation. Il existe par exemple des compléments nutritionnels tels que des boissons contenant jusqu’a 14g de protéines dans seulement 100mL. Ce type de formulation permet d’apporter un maximum de nutriments en un minimum de volume, tout en ayant un goût agréable pour rendre le produit plus appétant.18

Et en ce qui concerne le « profil anabolique durable », qu’est-ce que cela signifie ?
Dans un premier temps il est nécessaire que la dose de protéines soit suffisante pour stimuler la synthèse musculaire. Il faut en effet prendre en compte le fait qu’un muscle plus âgé est moins sensible à une faible quantité d’acides aminés en comparaison avec un muscle plus jeune.19 Ce sujet a notamment était expliqué plus en détails dans l’article intitulé « Quels sont les besoins protéiques des seniors et personnes âgées ? ».
Mais ce n’est pas tout. Le but est aussi de limiter la survenue d’une dégradation musculaire. Pour ce faire, il existe deux solutions complémentaires : réduire le temps séparant deux repas et donc multiplier les prises alimentaires, et préférer les protéines assimilées progressivement par l’organisme afin de toujours avoir une quantité d’acides aminés dans le sang supérieure au niveau de base. 5
Concernant la multiplication des repas, nous en revenons à ce qui a été décrit précédemment, à savoir qu’il faut une source de protéines facile à consommer. A propos de l’assimilation progressive, une protéine laitière possède cette propriété : il s’agit des caséines micellaires. 5 Cette notion a notamment était expliquée dans l’article « Quel est l’intérêt des caséines micellaires dans le sport ? ».
Est-ce les seuls intérêts des protéines laitières pour les personnes âgées ?
Non, il ne s’agit que des raisons principales. Par exemple, pour citer un autre élément intéressant, les caséines micellaires contiennent 2,6% de calcium, soit 2600mg/kg ! Ce qui en fait une excellente source de calcium contribuant au maintien du capital osseux (réduction du risque de survenue de l’ostéoporose) tout en participant à l’intégrité de la santé musculaire. Ceci est décrit plus en détails dans l’article « Quels sont les besoins protéiques des seniors et personnes âgées ? » disponible sur le blog.

Le saviez-vous ?
Pour les personnes âgées, notamment les plus de 60 ans, les protéines ne sont pas les seuls nutriments à surveiller. Étant donné que l’alimentation diminue dans sa globalité, la couverture nutritionnelle d’autres éléments peut être inférieure aux besoins, notamment : l’iode, le zinc, les omégas 3 (EPA et DHA) et, uniquement chez les femmes, le fer et la vitamine C. Ces données proviennent d’un dossier établi par l’ANSES en juin 2019.20
Un supplément alimentaire à destination des personnes âgées pourrait donc considérer plusieurs de ces nutriments afin d’être le plus complet possible.
Pour plus d’informations, n’hésitez pas à nous contacter.
Auteurs : Rémi Maleterre & Audrey Boulier.
*A [Acide aminé essentiel] : Acide aminé que l’organisme n’est pas capable de synthétiser et qu’il est indispensable d’apporter par l’alimentation
*B [BCAA, Branched-Chain Amino Acids] : Acides aminés ramifiés. Les BCAA sont des acides aminés essentiels, et ils correspondent à la Leucine, l’Isoleucine et la Valine.
*C [Anabolisme] : Synthèse des protéines musculaires.
*D [Catabolisme] : Dégradation des protéines musculaires.
________________________________________________________________________________________________
[1] Cruz-Jentoft AJ, Landi F, Schneider SM, Zúñiga C, Arai H, Boirie Y, Chen LK, Fielding RA, Martin FC, Michel JP, Sieber C, Stout JR, Studenski SA, Vellas B, Woo J, Zamboni M, Cederholm T (2014) Prevalence of and interventions for sarcopenia in ageing adults: a systematic review. Report of the International Sarcopenia Initiative
[2] Paddon-Jones D., Leidy H. (2014). Dietary protein and muscle in older persons. Current opinion in clinical nutrition and metabolic care vol. 17, 1:5-11. Epub September 12, 2014. https://doi.org/10.1097/MCO.0000000000000011
[3] Marzetti E., Calvani R., Tosato M., Cessari M., Di Bari M., Cherubini A., Collamati A., D’Angela E., Pahor M., Bernabel R., Landi F. (2017). « Sarcopenia: An Overview ». Aging Clinical and Experimental Research, vol. 29, no 1, p. 11‑17. Epub February 2, 2017. https://doi.org/10.1007/s40520-016-0704-5
[4] Kerksick C.M., Wilborn C.D., Roberts M.D., Smith-Ryan A., Kleiner S.M., Jäger R., Collins R., Cooke M., Davis J.N., Galvan E., Greenwood M., Lowery L.M., Wildman R., Antonio J. and Kreider R.B. (2018). ISSN exercise & sports nutrition review update: research & recommandations. Journal of the International Society of Sports Nutrition, 15:38. Epub August 01, 2018. https://doi.org/10.1186/s12970-018-0242-y
[5] Lacroix M., Bos C., Léonil J., Airinei G., Luengo C., Daré S., Benamouzig R., Fouillet H., Fauquant J., Tomé D., Gaudichon C. (2018). Compared with casein or total milk protein, digestion of milk soluble proteins is too rapid to sustain the anabolic postprandial amino acid requirement. Am J Clin Nutr 2006; 84:1070–9/ Epub January 23, 2018. https://doi.org/10.1556/1646.10.2018.10
[6] Ingredia. Prodiet 87 B Fluid – Nutrition facts . December 11, 2015.
[7] Ingredia. Prodiet 90 S – Nutrition facts . March 18, 2016.
[8] Atherton P.J., Smith K. (2012). Muscle protein synthesis in response to nutrition and exercise. J Physiol, 590(5):1049–1057. Epub January 31, 2012. https://doi.org/10.1113/jphysiol.2011.225003
[9] Report of an FAO Experte consultation. Dietary protein quality evaluation in human nutrition. ISSN 0254-4725 FAO and food nutrition paper 92. 31 March – 2 April, 2011.
[10] Robert R. Wolfe, Update on protein intake: importance of milk proteins for health status of the elderly, Nutrition Reviews, Volume 73, Issue suppl_1, August 2015, Pages 41–47. Epub July 11, 2015. https://doi.org/10.1093/nutrit/nuv021
[11] Imanipour V., Banaiifar A., Mahdi F., Naderi A., Sadeghi M. (2018). The effects of branch-chain amino acids on fatigue in the athletes. Interventional Medicine and Applied Science 2061-5094. Epub March 19, 2018. https://doi.org/10.1556/1646.10.2018.10
[12] J.C. Anthony, T.G. Anthony, S.R. Kimball, T.C. Vary, L.S. Jefferson (2000). Orally Administered Leucine Stimulates Protein Synthesis in Skeletal Muscle of Postabsorptive Rats in Association with Increased eIF4F Formation, The Journal of Nutrition, Volume 130, Issue 2. Pages 139–145. Epub February 01, 2000. https://doi.org/10.1093/jn/130.2.139
[13] C.S. Katsanos, H. Kobayashi, M. Sheffield-Moore, A. Aarsland, R.R Wolfe (2006). A high proportion of leucine is required for optimal stimulation of the rate ofmuscle protein synthesis by essential amino acids in the elderly. Am J Physiol Endocrinol Metab 2006;291(2):E381–7. Epub August 01, 2006. https://doi.org/10.1152/ajpendo.00488.2005
[14] Hope Barkoukis (2016). Nutritions recommendations in elderly and Aging. Practice-base nutrition Care, Medical clinics of North America. Vol 100, number 6, 1237-1250. Pub November 2016.
[15] Poortmans, J.R., Carpentier, A., Pereira-Lancha, L.O., & Lancha Jr., A. (2012). Protein turnover, amino acid requirements and recommendations for athletes and active populations. Brazilian Journal of Medical and Biological Research, 45(10), 875-890. Epub June 06, 2012.https://dx.doi.org/10.1590/S0100-879X2012007500096
[16] I.Y. Kim, S. Schutzler, A.M. Schrader, H.J. Spencer, G. Azhar, R.R. Wolfe, A.A. Ferrando (2018). Protein intake distribution pattern does not affect anabolic response lean body mass, muscle strength or function over 8 weeks in older adults: a randomize-controlled trial. Clinical Nutrition, Vol 37, Issue 2, 488-493. Epub Avril 2018. https://doi.org/10.1016/j.clnu.2017.02.020
[17] V. Pouyet, A. Giboreau, G. Cuvelier, L. Benattar (2015). Les préférences culinaires des personnes âgées vivant en institution : facteurs d’appréciation sensoriels et cognitifs. Cahier de Nutrition et Diététique 2015. Vol 50, n°5, p235-289. Pub November 2015. https://doi.org/10.1016/j.cnd.2015.03.008
[18] Ingredia, Prodiet Fluid. The Innovative Micellar Casein dedicated to high protein beverages. https://www.prodiet-fluid.com/
[19] D. Dardevet, D. Rémond, M.A. Peyron, I. Papet, I. Savary-Auzeloux, L. Mosoni (2012). Muscle wasting and resistance of muscle anabolisme : the « anabolic threshold concept » for adapted nutritional strategies during sarcopenia. The Scientific World Journal, Vol 2012, ID 269531. Epub December 03, 2012. https://dx.doi.org/10.1100/2012/269531
[20] Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES). (2019) Dossier de presse – Repères alimentaires pour populations spécifiques. Consulté le 2 juillet 2019. https://www.anses.fr/fr/content/rep%C3%A8res-alimentaires-pour-les-populations-sp%C3%A9cifiques-enfants-femmes-enceintes-allaitantes
Quels sont les besoins protéiques des seniors et personnes âgées ?
Il existe un certain nombre de complications dues à l’âge. Une des complications majeures est la perte de masse musculaire qui peut notamment affecter de façon importante la qualité de vie en limitant la mobilité des seniors.
A partir de quel âge considérons-nous ces problèmes musculaires ?
Il existe globalement trois catégories d’âges à définir :
- Les jeunes seniors, c’est-à-dire les personnes ayant entre 40 et 65 ans. Les pertes musculaires sont encore minimes, il est surtout important d’agir afin de les PRÉVENIR ;
- Les seniors entre 65 et 75 ans. Certains problèmes musculaires peuvent survenir, l’objectif est alors de les PRÉVENIR et de les TRAITER ;
- Les personnes âgées de plus de 75 ans. Les problèmes musculaires sont accentués. Davantage de maladies liées à l’âge peuvent alors être installées et il est possible de les TRAITER.
L’objectif est alors de déterminer comment la modification de son mode de vie peut permettre de prévenir et de limiter le développement des maladies musculaires liées à l’âge.
Comment surviennent ces complications liées à l’âge ?
A partir de 40-50 ans, une diminution de la masse musculaire et des capacités physiques commence à apparaître. Cela représente 3 à 8% de perte de masse musculaire tous les 10 ans en fonction du mode de vie1 2. C’est le début potentiel de la sarcopénie, c’est-à-dire la perte de masse musculaire liée à l’âge, une maladie multifactorielle (figure 1)3.
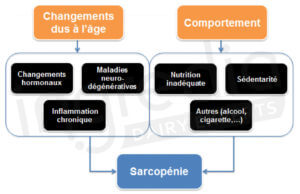
Figure n°1 : Causes principales de la sarcopénie3.
Il est primordial de réagir le plus tôt possible afin d’éviter de tomber dans le cercle vicieux de la perte de masse musculaire liée à l’âge (figure n°2).
Pour cela, nous pouvons agir sur les causes comportementales (figure 1), notamment sur l’alimentation et la sédentarité3.
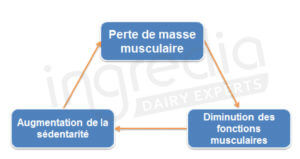
Figure 2 : Le « cercle vicieux » de la sarcopénie.
Pouvons-nous agir en modifiant notre alimentation ?
Oui, c’est possible. Les recommandations qui vont suivre permettent aussi bien de prévenir les troubles musculaires liés à l’âge (telle que la sarcopénie) que de les pallier. Celles-ci devraient donc aussi bien être suivies par les jeunes seniors que par les personnes plus âgées.
Pour stimuler l’anabolisme* des muscles âgés, une plus forte dose de protéines est nécessaire par rapport à des muscles plus jeunes. Une étude de 2012 a démontré qu’une petite quantité d’environ 5g de protéines suffisait pour déclencher l’anabolisme chez de jeunes adultes, et une réponse anabolique maximale était observée à partir d’une vingtaine de grammes. Alors que pour des individus plus âgés, une quantité deux fois plus importante était nécessaire pour les mêmes résultats (soit une quantité comprise entre 30 et 40g pour une réponse maximale, comme l’indique la figure n°3) 1 2 3 4. Ce phénomène a également été démontré au cours d’une méta-analyse de 2015 : les quantités de protéines retenues pour favoriser un anabolisme optimal sont de 0,24g/kg de poids corporel par repas pour les jeunes adultes, et 0,40g/kg pour les personnes plus âgées5. D’où l’importance d’augmenter ses apports protéiques pour les seniors et personnes âgées.
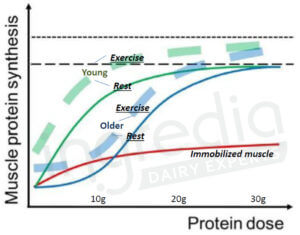
Figure n°3 : Synthèse protéique musculaire en fonction de la dose de protéines ingérée chez de jeunes adultes (courbes vertes) et des personnes âgées (courbes bleues)4.
Les courbes pleines correspondent à l’anabolisme observé pour des muscles au repos, et les courbes en pointillés pour des muscles ayant subi une activité physique.
Le point le plus important est d’apporter à l’organisme suffisamment de protéines afin d’augmenter la synthèse protéique musculaire. Pour les jeunes seniors ou les personnes âgées, 1,2g de protéines par kilogramme de masse corporelle par jour est un minimum pour pouvoir maintenir sa masse musculaire et améliorer ses capacités physiques 2 9 10. Certaines études démontrent même qu’il serait utile de consommer jusqu’à 1,5g/kg/j de protéines pour assurer un maintien efficace des fonctions musculaires 11 12 13. Cependant, les apports protéiques conseillés à l’âge adulte sont de 0,8g/kg/j : il s’agit donc de presque doubler ses apports protéiques journaliers. Il peut ainsi être difficile de consommer autant de protéines, notamment si l’appétit diminue. C’est la raison pour laquelle les suppléments protéiques peuvent être une bonne alternative pour couvrir ces besoins protéiques en cas de dénutrition et sous suivi médical 5.
Est-ce vraiment nécessaire pour les seniors et les personnes âgées de consommer autant de protéines ? Ne serait-ce pas dangereux ?
On imagine souvent qu’un régime riche en protéines peut entraîner des complications rénales. Cependant, à l’heure actuelle, aucune étude n’a démontré qu’un régime riche en protéines pouvait entraîner des problèmes rénaux chez des personnes saines14. Néanmoins, un régime hyper protéiné est déconseillé chez les sujets ayant des problèmes rénaux connus ou ayant des prédispositions. En effet, dans ce cas une consommation protéique supérieure à 0.8g/kg/j peut se révéler délétère chez certaines personnes15.
Les protéines seules suffisent ou une activité physique est obligatoire ?
L’activité physique constitue un stimulus qui permet d’amplifier la synthèse protéique musculaire. La figure n°4 est issue d’une étude de 2013 comparant la synthèse protéique musculaire en fonction de la dose de protéine ingérée (ici, des protéines solubles du lait) et de l’activité physique. On remarque ainsi que l’activité physique permet d’augmenter significativement le niveau d’anabolisme16.
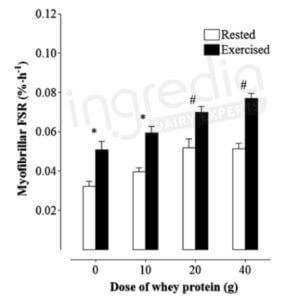
Figure n°4 : Synthèse protéique musculaire en fonction de la quantité de protéine ingérée et de l’activité physique 13
Myofibrillar FSR = « Myofibrillar Synthetic Rate », correspondant au taux de synthèse musculaire.
La plupart des études semblent indiquer qu’une supplémentation protéique sans activité physique ne permet pas une augmentation durable et suffisante de la masse musculaire des sujets âgés 3 17. La supplémentation protéique seule apparaît donc comme insuffisante. C’est pour cette raison que l’Organisation Mondiale de la Santé recommande aux personnes âgées de plus de 65 de pratiquer au moins 150 minutes d’activité d’endurance à intensité modérée ou 75 minutes à intensité soutenue par semaine, ainsi que des exercices de renforcement musculaire au moins 2 fois par semaine1318.
On parle beaucoup des protéines, mais s’agit-il des seuls nutriments à apporter en quantités plus importantes ?
Non, ce ne sont pas les seuls. Les micronutriments ont également une importance primordiale, et notamment le calcium et la vitamine D. Un apport suffisant de ceux-ci participe au maintien de la masse musculaire et de la force, mais pas seulement ! En effet, le calcium et la vitamine D sont également essentiels pour assurer le maintien du capital osseux 19.
Faisons d’abord un rappel en ce qui concerne notre capital osseux : il existe un mécanisme de renouvellement similaire à celui des protéines. Globalement, jusqu’à l’âge d’environ 50 ans, la densité osseuse reste stable car un équilibre existe entre synthèse et dégradation. Cependant, après 50 ans, la dégradation peut dépasser la synthèse et la diminution de la densité osseuse survient. Une absence de traitement peut conduire à l’ostéoporose. Les os deviennent alors poreux et fragiles, et le risque de fracture est important. Ajouté à cela une potentielle diminution de la masse musculaire et de la force au travers de la sarcopénie, et nous avons ainsi une augmentation conséquente du risque de chute grave pouvant engendrer d’importants problèmes de mobilités 20.
Consommer davantage de vitamine D et de calcium permet d’assurer un meilleur maintien de son capital musculaire et osseux. Cependant, la sous-consommation de vitamine D est courante : les apports journaliers conseillés par l’ANSES sont de 15µg pour les adultes. Or la consommation moyenne est de 3,1µg/j en France, soit 5 fois inférieure aux recommandations de l’ANSES ! Il est donc indispensable d’apporter davantage de vitamine D afin de combler ce déficit potentiel 21.
Pour le calcium, il est recommandé de consommer 900 à 1200mg par jour pour les personnes de plus de 50 ans. La consommation journalière moyenne est suffisante sans être non plus excessive puisqu’elle se situe autour de 900mg. Il reste donc important de veiller à avoir une alimentation suffisamment riche en calcium 22.
D’accord, alors quels aliments devrions-nous consommer ?
La question est très judicieuse car toutes les protéines ne se valent pas. Il est primordial de sélectionner une source de protéines de bonne qualité correspondant à nos besoins. Et cela fera justement tout l’objet du prochain article qui détaillera l’intérêt que peuvent représenter les protéines laitières pour prévenir la sarcopénie.
Pour plus d’informations sur nos protéines de lait et notre expertise, n’hésitez pas à nous contacter.
Auteurs : Rémi Maleterre & Audrey Boulier.
* [Anabolisme] : Synthèse des protéines musculaires.
________________________________________________________________________________________________
[1] Paddon-Jones D., Leidy H. (2014). Dietary protein and muscle in older persons. Current opinion in clinical nutrition and metabolic care vol. 17, 1:5-11. Epub September 12, 2014. https://doi.org/10.1097/MCO.0000000000000011
[2] Marzetti E., Calvani R., Tosato M., Cessari M., Di Bari M., Cherubini A., Collamati A., D’Angela E., Pahor M., Bernabel R., Landi F. (2017). « Sarcopenia: An Overview ». Aging Clinical and Experimental Research, vol. 29, no 1, p. 11‑17. Epub February 2, 2017. https://doi.org/10.1007/s40520-016-0704-5
[3] Cruz-Jentoft A.J., Bahat G., Bauer J., Boirie Y., Bruyère O., Cerderholm T., Cooper C., Landi F., Rolland Y., Sayer A.A., Schneider S.M., Sieber C.C., Topinkova E., Vandewoude M., Visser M., Zamboni M. (2018). Sarcopenia: revised European consensus on definition and diagnosis. Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 39(4): p. 412-23. Epub January 01, 2019. https://doi.org/10.1093/ageing/afy169
[4] D. Dardevet, D. Rémond, M.A. Peyron, I. Papet, I. Savary-Auzeloux, L. Mosoni (2012). Muscle wasting and resistance of muscle anabolisme : the « anabolic threshold concept » for adapted nutritional strategies during sarcopenia. The Scientific World Journal, Vol 2012, ID 269531. Epub December 03, 2012. https://dx.doi.org/10.1100/2012/269531
[5] K. Dideriksen, S. Reitelseder, L. Holm (2013). Influence of amino acids dietary protein and physical activity on muscle mass development in humans. Nutrients 2013, 5(3), 852-876. Epubl March 13, 2013. https://doi.or/10.3390/nu5030852
[6] D. Tomé (2018 – Lille, France) – Protein Digestibility Scores & Nutrition, AgroParisTech – Departement of Life Sciences and Health; INRA, UMR Nutrition physiology and ingestive behavior.
[7] Moore DR, Robinson MJ, Fry JL, Tang JE, Glover EI, Wilkinson SB, Prior T, Tarnopolsky MA, Phillips SM. Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am J Clin Nutr 2009;89(1):161–8.
[8] Moore DR, Churchward-Venne TA, Witard O, Breen L, Burd NA, Tipton KD, Phillips SM. Protein ingestion to stimulate myofibrillar protein synthesis requires greater relative protein intakes in healthy older versus younger men. J Gerontol A Biol Sci Med Sci 2015;70(1):57–62.
[9] Cruz-Jentoft AJ, Landi F, Schneider SM, Zúñiga C, Arai H, Boirie Y, Chen LK, Fielding RA, Martin FC, Michel JP, Sieber C, Stout JR, Studenski SA, Vellas B, Woo J, Zamboni M, Cederholm T (2014) Prevalence of and interventions for sarcopenia in ageing adults: a systematic review. Report of the International Sarcopenia Initiative (EWGSOP and IWGS). Age Ageing 43:748–759. doi:10.1093/ageing/afu115
[10] Traylor D.A., Gorissen S.HM, Phllips S.M. (2018). Perspective: protein requirements and optimal intakes in aging: are we ready to recommend more than the recommended daily allowance? Advances in Nutrition, Volume 9, Issue 3, Pages 171–182. Epub May 15, 2018. https://doi.org/10.1093/advances/nmy003
[11] Murphy CH, Saddler NI, Devries MC, McGlory C, Baker SK, Phillips SM. Leucine supplementation enhances integrative myofibrillar protein synthesis in free-living older men consuming lower- and higher-protein diets: a parallel-group crossover study. Am J Clin Nutr 2016;104(6):1594–606
[12] Kim IY, Schutzler S, Schrader A, Spencer H, Kortebein P, Deutz NE, Wolfe RR, Ferrando AA. Quantity of dietary protein intake, but not pattern of intake, affects net protein balance primarily through differences in protein synthesis in older adults. Am J Physiol Endocrinol Metab 2015;308(1):E21–8.
[13] Mitchell CJ, Milan AM, Mitchell SM, Zeng N, Ramzan F, Sharma P, Knowles SO, Roy NC, Sjodin A, Wagner KH, et al. The effects of dietary protein intake on appendicular lean mass and muscle function in elderly men: a 10-wk randomized controlled trial. Am J Clin Nutr 2017;106(6):1375–83.
[14] M. Cuenca-Sánchez, D. Navas-Carrillo, E. Orenes-Piñero (2015). Controversies Surrounding High-Protein Diet Intake: Satiating Effect and Kidney and Bone Health, Advances in Nutrition, Volume 6, Issue 3, May 2015, Pages 260–266. Epub May 2015. https://doi.org/10.3945/an.114.007716
[15] M.C. Huang, M.E Chen, H.C. Hung, H.C. Chen, W.T. Chang, C.H. Lee, Y.Y. Wu, H.C. Chiang, S.J. Hwang (2008). Inadequate energy and excess protein intakes may be associated with worsening renal function in chronic kidney disease. J Ren Nutr 2008;18:187–94. Epub March 2008. https://doi.org/10.1053/j.jrn.2007.08.003
[16] O.C. Witard, S.R. Jackman, L. Breen, K. Smith, A. Selby, K.D. Tipton (2014). Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise, The American Journal of Clinical Nutrition, Volume 99, Issue 1, Pages 86–95. Pub January 2014. https://doi.org/10.3945/ajcn.112.055517
[17] Tieland M, van de Rest O, Dirks ML et al. Protein supplementation improves physical performance in frail elderly people: a randomized, double-blind, placebo-controlled trial. J Am Med Dir Assoc 2012b; 13: 720–6. Epub October 2012. https://doi.org/10.1016/j.jamda.2012.07.005
[18] OMS (Organisation Mondiale de la Santé), « L’activité physique des personnes âgées » [consulté le 01 juillet 2019]. https://www.who.int/dietphysicalactivity/factsheet_olderadults/fr/
[19] B. Hamilton (2010). Vitamin D and Human Skeletal Muscle. Scand J Med Sci Sports. 20:182-190. E pub July 8, 2019. https://doi.or/10.1111/j.1600-0838.2009.01016.x
[20] J.A. Kanis, L.J. Melton, C. Christiansen, C.C. Johnston, N. Khaltaev (1994). The diagnosis of osteoporosis. Journal of bone and mineral research. Vol 9:8. Pub August 1994. https://doi.org/10.1002/jbmr.5650090802
[21] National agency of food safety, environment and work (ANSES). (2019) Vitamine D: presentation, besoins nutritionnels et sources alimentaires. At : https://www.anses.fr/fr/content/vitamine-d
[22] National agency of food safety, environment and work (ANSES). (2019) Le Calcium: presentation, sources alimentaires et besoins nutritionnels. At : https://www.anses.fr/fr/content/le-calcium
Quel est l’intérêt des caséines micellaires dans le sport ?
L’amélioration des performances rime toujours avec développement musculaire. Et pour cela il n’y a pas de secret : un entraînement et une alimentation adaptés sont indispensables.
En ce qui concerne l’alimentation, elle doit notamment apporter suffisamment de protéines puisqu’il s’agit des briques de construction des muscles. Pour des raisons de praticité, il est souvent intéressant pour les sportifs de consommer des suppléments protéiques. Et les caséines micellaires peuvent véritablement représenter un ingrédient de choix ! Laissez cet article vous en convaincre !
Les caséines micellaires ? Qu’est-ce que c’est ?
Le lait contient deux types de protéines : les protéines solubles (couramment appelées whey protein en anglais) et les caséines micellaires (micellar casein). Elles constituent respectivement environ 20% et 80% des protéines laitières1.
Au niveau de la composition, ces protéines sont relativement similaires : les teneurs en acides aminés essentielsA sont très proches, tout comme la teneur en BCAAB (tableau 1). Ces derniers ont un effet positif sur le métabolisme protéique : ils favorisent l’anabolismeC tout en réduisant le catabolismeD 2 3 .La Leucine est le BCAA le plus important pour stimuler la synthèse protéique musculaire. D’après le rapport de l’ISSN (International Society of Sports Nutrition) de 2018 concernant les recommandations en matière de nutrition sportive, la dose idéale de Leucine pour profiter de ses effets anaboliques est comprise entre 1,7 et 3,5g par prise2 4.
La différence principale entre ces deux groupes de protéines concerne plutôt la vitesse de digestion : les protéines solubles sont digérées rapidement et elles sont totalement absorbées après environ 3h, alors que l’assimilation des caséines micellaires sera beaucoup plus progressive et pourra prendre jusqu’à plus de 7h 5.
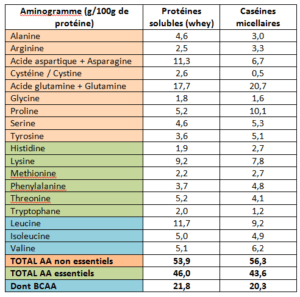
Tableau n°1 : Aminogramme des protéines solubles du lait (whey) et des caséines micellaires6 7
Mais après l’entraînement, je souhaite des protéines rapides ! En quoi les caséines pourraient être intéressantes pour moi ?
Les protéines « rapides » n’ont pas que des avantages : certes elles sont assimilées très rapidement par l’organisme, mais après seulement quelques heures la concentration en acides aminés dans le sang chute brutalement à tel point qu’elle devient inférieure à la concentration initiale avant l’ingestion des protéines (on parle de concentration basale, appelée baseline sur la figure 1)5
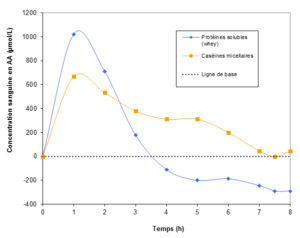
Figure 1 : Concentration en acides aminés dans le sang en fonction du temps
Au cours de cette étude5, les sujets en bonne santé ont ingéré une dose (≈23g) de Whey (Δ) ou de Caséines micellaires (O). La concentration sanguine en acides aminés a ensuite été mesurée durant 8h. Baseline : il s’agit de la concentration en acides aminés basale, c’est-à-dire la concentration avant l’ingestion des protéines.
Lorsque la concentration en acides aminés dans le sang est supérieure au niveau de base, la synthèse de protéines musculaires est favorisée. Cependant, lorsque celle-ci est inférieure à cette concentration basale, ce sera plutôt la dégradation protéique qui sera favorisée…
Pourtant, j’ai entendu dire que les caséines étaient des protéines anti-catabolisantes, et non anabolisantes ! Et que c’était pour cette raison que l’on en prenait avant de dormir !
C’est vrai ! C’est un excellent produit à prendre avant de dormir pour profiter d’un apport d’acides aminés tout au long de la nuit ! Puisque les caséines sont effectivement bien absorbées et assimilées par l’organisme même lors du sommeil1.
Cependant elles ont bel et bien un effet sur l’anabolisme, et cela a été prouvé par une étude menée en 2012 au cours de laquelle 15 personnes ont pris soit des caséines, soit un placebo avant de dormir. Au cours de la nuit, la synthèse protéique musculaire ainsi que la dégradation ont été mesurées. C’est ainsi que l’on a pu constater que les caséines n’ont pas eu de réel effet sur le catabolisme mais ont permis d’amplifier l’anabolisme. 2 8
Et il est d’ailleurs aussi intéressant de prendre ces caséines avant de dormir : différentes études, notamment une menée sur des joueurs de football professionnels, ont démontré que celles-ci permettaient d’améliorer non seulement les performances (notamment en augmentant l’anabolisme nocturne), mais aussi la récupération tout en réduisant les douleurs musculaires3 4.
D’accord, mais comme les caséines sont absorbées aussi lentement, est-ce qu’elles contribuent aussi bien à l’anabolisme que la whey ?
Oui ! Une étude de 2011 a mesuré la synthèse des protéines musculaires sur 17 personnes ayant pris soit de la whey, soit des caséines, soit de l’eau (témoin) après un exercice de musculation. Résultat : sur une durée totale de 6h, la whey et les caséines stimulent autant l’anabolisme musculaire !5
D’autres études ont comparé l’impact de la whey ou des caséines sur les performances sportives et sur les effets concernant la prise de muscle et la perte de masse grasse. Il a ainsi été soulevé qu’il n’y avait pas de différences significatives entre ces deux protéines.6
Les deux protéines stimulent autant l’anabolisme, mais la whey pourrait favoriser le catabolisme après quelques heures… Dans ce cas, les caséines seraient plus intéressantes ?
C’est effectivement la question que l’on peut se poser. Si l’on s’intéresse à la balance protéique globale, on peut émettre l’hypothèse que les caséines seraient en effet plus intéressantes que la whey (figure 2).5
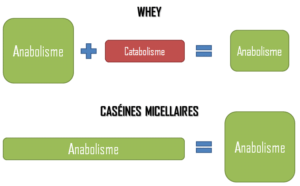
Figure 2 : Prédiction de la balance protéique globale obtenue suite à la consommation de whey ou de caséines micellaires5.
Sur le marché, il est possible de trouver des caséinates. Ces protéines sont obtenues avec des procédés chimiques, tandis que les caséines micellaires sont produites par un traitement non dénaturant, permettant ainsi de conserver la structure native des protéines. Ingredia mène actuellement des études visant à mieux caractériser et comparer ces deux protéines.
Pour plus d’informations, n’hésitez pas à nous contacter.
Auteurs : Rémi Maleterre & Audrey Boulier.
*A [Acide aminé essentiel] : Acide aminé que l’organisme n’est pas capable de synthétiser et qu’il est indispensable d’apporter par l’alimentation
*B [BCAA, Branched-Chain Amino Acids] : Acides aminés ramifiés. Les BCAA sont des acides aminés essentiels, et ils correspondent à la Leucine, l’Isoleucine et la Valine.
*C [Anabolisme] : Synthèse des protéines musculaires.
*D [Catabolisme] : Dégradation des protéines musculaires.
____________________________________________________________________________
[1] Swaisgood H.E. (1982). Chemistry of milk protein. Fox P.F. (e.): Developments in Dairy Chemistry. Elsevier Applied Science Publishers, London, UK, 1-59.
[2] Kerksick C.M., Wilborn C.D., Roberts M.D., Smith-Ryan A., Kleiner S.M., Jäger R., Collins R., Cooke M., Davis J.N., Galvan E., Greenwood M., Lowery L.M., Wildman R., Antonio J. and Kreider R.B. (2018). ISSN exercise & sports nutrition review update: research & recommandations. Journal of the International Society of Sports Nutrition, 15:38. Epub August 01, 2018. https://doi.org/10.1186/s12970-018-0242-y
[3] Imanipour V., Banaiifar A., Mahdi F., Naderi A., Sadeghi M. (2018). The effects of branch-chain amino acids on fatigue in the athletes. Interventional Medicine and Applied Science 2061-5094. Epub March 19, 2018. https://doi.org/10.1556/1646.10.2018.10
[4] Jager R., Kerksick C.M., Campbell B.I., Cribb P.J., Wells S.D., Skwiat T.M., Purpura M., Ziegenfuss T.N., Ferrando A.A., Arent S.M., Smith-Ryan A.E., Stout J.R., Arciero P.J., Ormsbee M.J., Taylor L.W., Wilborn C.D., Kalman D.S., Kreider R.B., Willoughby D.S., Hoffman J.R., Krzykowski J.L., Antonio J. International society of sports nutrition position stand: protein and exercise. J Int Soc Sports Nutr. 14:20. Epub June 20, 2017. https://doi.orf/10.1186/s12970-017-0177-8
[5] Lacroix M., Bos C., Léonil J., Airinei G., Luengo C., Daré S., Benamouzig R., Fouillet H., Fauquant J., Tomé D., Gaudichon C. (2018). Compared with casein or total milk protein, digestion of milk soluble proteins is too rapid to sustain the anabolic postprandial amino acid requirement. Am J Clin Nutr 2006; 84:1070–9/ Epub January 23, 2018. https://doi.org/10.1556/1646.10.2018.10
[6] Ingredia. Prodiet 87 B Fluid – Nutrition facts . December 11, 2015
[7] Ingredia. Prodiet 90 S – Nutrition facts . March 18, 2016.
[8] Res P.T., Groen B., Pennings B., Beelen M., Wallis G.A., Gijsen A.P., Senden J.M., Van Loon L.J. (2012) . Protein ingestion before sleep improves postexercise overnight recovery. Med Sci Sports Exerc 2012;44:1560–9. Epub January 2012. https://doi.org/10.1249/MSS.0b013e31824cc363
[9] Rasmussen C.J. (2008). Nutritional Supplements for Endurance Athletes. Nutritionnal supplements in sports and exercise, 369-407. https://doi.org/10.1007/978-1-59745-231-1_11
[10] Abbott W., Brett A., Cackburn E., Clifford T. (2019). Presleep casein protein ingestion: acceleration of functional recovery in professional soccer players. Int J Sports Physiol Perform. 14(3):385-391. Epub Feb 17, 2019. https://doi.org/10.1123/ijspp.2018-0385
[11] Snijders T., Res P.T., Smeets J.SJ., Van Vliet S., Van Kranenburg J., Maase K., Kies A.K., Verdijk L.B., Van Loon L.JC. (2015). Protein ingestion before sleep increases muscle mass and strength gains during prolonged resistance-type exercise training in healthy young men. The Journal of Nutrition, 145(6):1178-1184. Epub April 29, 2015. https://doi.org/10.3945/jn.114.208371
[12] Reitelseder S., Agergaard J., Doessing S., Helmark I.C., Lund P., Kristensen N.B., Frystyk J., Flyvbjerg A., Schjerling P., Van Hall G., Kjaer M., Holm L. (2011). Whey and casein labeled with L-[1-13C]leucine and muscle protein synthesis: effect of resistance exercise and protein ingestion. Am J Physiol Endocrinal Metab, 300, pp. E231-E242. Epub January 01, 2011. https://doi.org/10.1152/ajpendo.00513.2010
[13] Wilborn C.D., Taylor L.W., Outlaw J., Williams L., Campbell B., Foster C.A., Smith-Ryan A., Urbina S., Hayward S. (2013). The effects of pre- and postexercise whey vs. casein protein consumption on body composition and performance measures in collegiate female athletes. J Sports Sci Med 2013;12:74–9. Epub March 01, 2013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3761774/